Syndromes de vieillissement prématuré et lipodystrophies impliquant des protéines prénylées
INSERM, U 1251Marseille Medical Genetics
Faculté de Médecine
27 Bd Jean Moulin
13385 Marseille Cedex 05
FRANCE - Marseille
Site web - nicolas.levy@univ-amu.fr -
Principal investigator
Nicolas Levy, PU-PH (MD., PhD., HDR)

Research themes
Les objectifs principaux de notre unité INSERM U 1251 sont d’une part d’étudier les mécanismes génétiques et physiopathologiques impliqués dans les pathologies génétiques rares et d’autre part de développer des approches thérapeutiques et des preuves de concept précliniques in vitro et in vivo dans un cadre de recherche translationnelle. Notre laboratoire est associé au Département de Génétique Médicale et Biologie Cellulaire (DGMBC) de l’hôpital Timone enfants dirigé par le Pr. Nicolas Lévy, et entretient des liens très étroits avec de nombreux autres services cliniques et laboratoires du CHU et hors CHU. Notre laboratoire rassemble des chercheurs, des enseignants chercheurs et des médecins et bénéficie des cohortes exceptionnelles d’échantillons de patients caractérisés cliniquement et inclus dans les collections du Centre de Ressources Biologiques « Tissus, ADN, Cellules » (CRB-TAC) du DGMBC, organisme certifié NF 96-900 et ISO 9001. La plupart de nos travaux, y compris les plus fondamentaux, s’inscrivent ainsi dans un contexte de recherche translationnelle, contribuant au diagnostic et à la prise en charge des malades, lesquels alimentent en permanence nos projets de recherche dans le but d’une meilleure compréhension des maladies, de leur possible prévention et de leur traitement dans le cadre de la valorisation des résultats de recherche obtenus, avec le conseil de l’INSERM Transfert ou la SATT (Sociétés d’Accélération du Transfert de Technologies). En 2003, l’équipe du Pr. Levy a identifié la mutation responsable de la Progéria de Hutchinson-Gilford (HGPS; OMIM # 176670), une maladie génétique rare caractérisée par un vieillissement prématuré et accéléré (De Sandre-Giovannoli et al, 2003), et a conduit en 2008 un essai thérapeutique Européen pour des patients atteints de Progéria (ClinicalTrials.gov #NCT00731016), après la publication de l’article démontrant un effet des principes actifs identifiés in vitro et in vivo (Varela et al, 2008). Par ailleurs, sur la base du modèle de souris LmnaG609G/G609G que notre équipe a développé en collaboration avec Carlos Lopez-Otin (Espagne, Oviedo), nous avons obtenu la preuve de principe préclinique de l’efficacité d’un traitement par oligonucléotides antisens (AON), permettant de réduire la production de progérine (Harhouri et al, 2016; Osorio et al, 2011) .
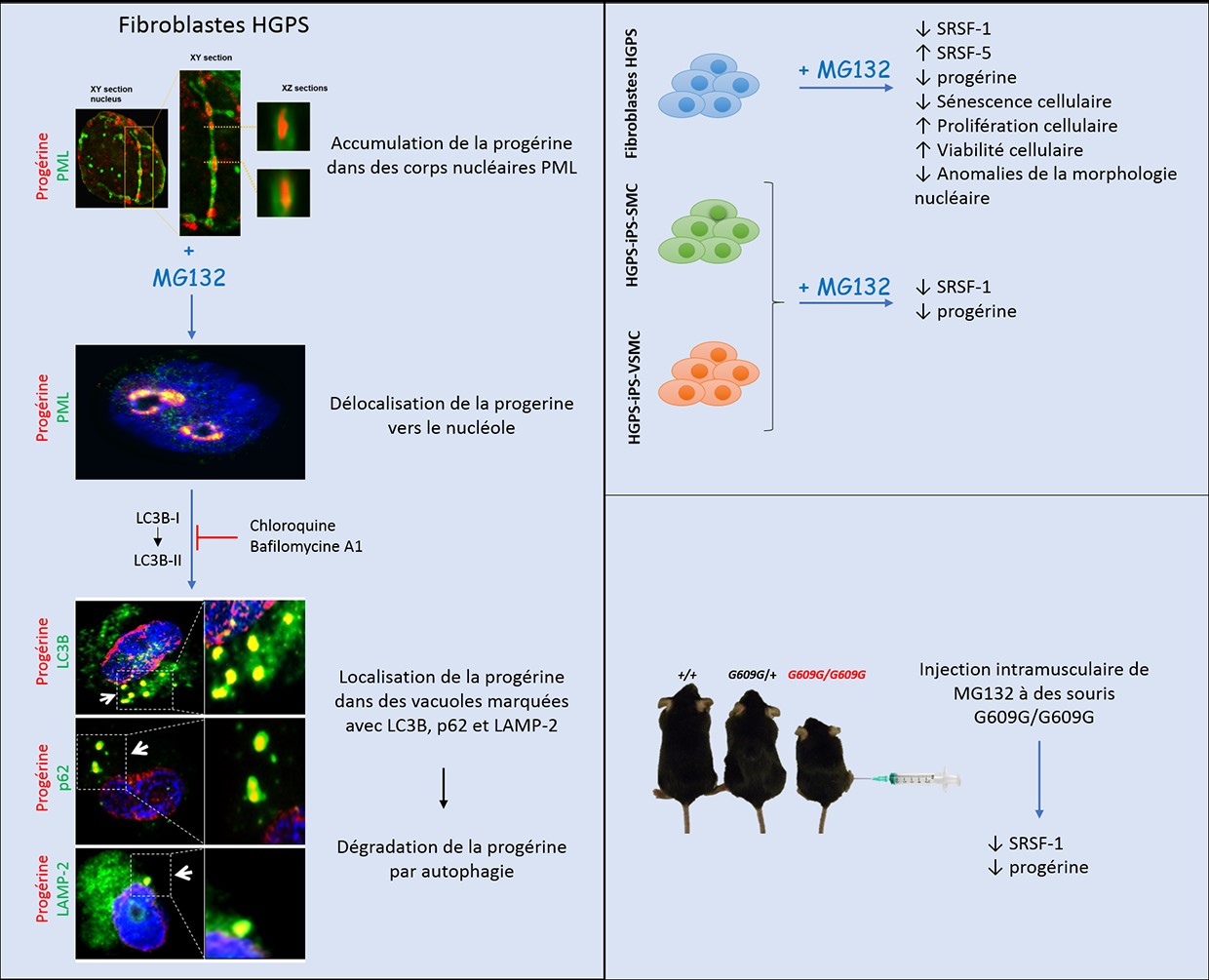
En 2017, nous avons montré que la progérine, protéine toxique dont l’accumulation cause la Progéria, est séquestrée dans des corps nucléaires promyélocytaires de forme anormale, identifiés comme nouveaux biomarqueurs de maladie. L’inhibiteur du protéasome MG132 induit la dégradation de la progérine par macroautophagie d’une part et d’autre part réduit fortement sa production par la réduction des niveaux d’expression de SRSF-1 et l’augmentation des niveaux d’expression de SRSF-5, contrôlant l’épissage aberrant de l’ARNm du précurseur de la progérine, la prélamine A. Le traitement par MG132 améliore les phénotypes des fibroblastes HGPS, réduit la sénescence cellulaire et améliore la viabilité et la prolifération des fibroblastes HGPS. L’injection de MG132 dans le muscle squelettique des souris modèle de la Progéria (LmnaG609G / G609G) réduit localement les taux d’expression de la progérine et de SRSF-1. Au total, nous avons montré une réduction de la progérine basée sur la double action de MG132 (Harhouri et al, 2017) et proposons une classe prometteuse de molécules pour un futur développement thérapeutique chez les enfants atteints de Progéria.
Descriptive figure
Publications
De Sandre-Giovannoli A, Bernard R, Cau P, Navarro C, Amiel J, Boccaccio I, Lyonnet S, Stewart CL, Munnich A, Le Merrer M et al (2003) Lamin a truncation in Hutchinson-Gilford progeria. Science 300: 2055
Harhouri K, Navarro C, Baquerre C, Da Silva N, Bartoli C, Casey F, Mawuse GK, Doubaj Y, Levy N, De Sandre-Giovannoli A (2016) Antisense-Based Progerin Downregulation in HGPS-Like Patients’ Cells. Cells 5
Harhouri K, Navarro C, Depetris D, Mattei MG, Nissan X, Cau P, De Sandre-Giovannoli A, Levy N (2017) MG132-induced progerin clearance is mediated by autophagy activation and splicing regulation. EMBO molecular medicine 9: 1294-1313
Osorio FG, Navarro CL, Cadinanos J, Lopez-Mejia IC, Quiros PM, Bartoli C, Rivera J, Tazi J, Guzman G, Varela I et al (2011) Splicing-directed therapy in a new mouse model of human accelerated aging. Science translational medicine 3: 106ra107
Varela I, Pereira S, Ugalde AP, Navarro CL, Suarez MF, Cau P, Cadinanos J, Osorio FG, Foray N, Cobo J et al (2008) Combined treatment with statins and aminobisphosphonates extends longevity in a mouse model of human premature aging. Nat Med 14: 767-772
Composition de l'équipe
Nicolas Levy, PU-PH, directeur de l’unité Inserm U 1251, chef d’équipe (nicolas.levy[at]univ-amu.fr)
Annachiara De Sandre Giovannoli, PH (annachiara.desandre-giovannoli[at]univ-amu.fr)
Patrice Roll, PU-PH (patrice.roll[at]univ-amu.fr)
Karim Harhouri, Postdoc (karim.harhouri[at]univ-amu.fr)
Sahar Elouej, Postdoc (sahar.elouej[at]univ-amu.fr
Elise Kaspi, MCU-PH (elise.kaspi[at]univ-amu.fr)
Catherine BARTOLI, IE (catherine.bartoli[at]univ-amu.fr)
Diane Frankel, doctorante (diane.frankel[at]univ-amu.fr)
Valérie Delecourt, doctorante (valeriedelecourt22[at]gmail.com)