Cycle cellulaire, autophagie et cancer
Centre de Recherches en Cancérologie de Toulouse (CRCT)UMR1037 INSERM / Université Toulouse III Paul Sabatier / ERL5294 CNRS
2 avenue Hubert Curien
CS53717
31037 Toulouse Cedex 1- FRANCE - Toulouse
Site web - stephane.manenti@inserm.fr - 0582741635
Responsable d'équipe
Stéphane Manenti

Thématiques de recherche
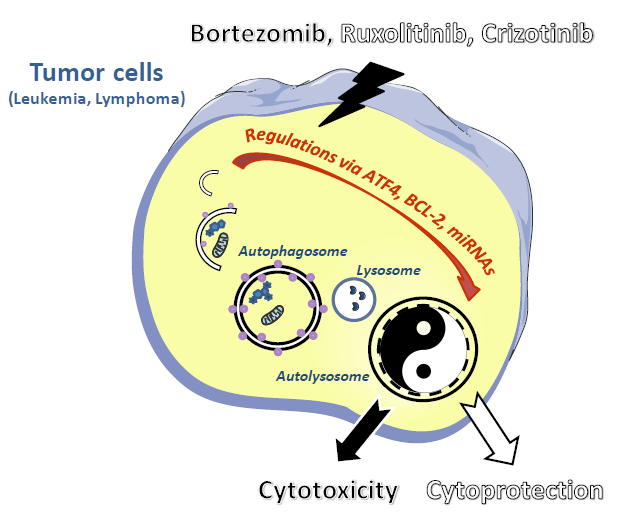
Notre groupe de recherche dans l’équipe du Dr S. Manenti, au sein du Centre de Recherches en Cancérologie de Toulouse, s’intéresse à l’autophagie dans plusieurs types de cancers hématopoïétiques : les leucémies aiguës myéloïdes (LAM) [2,3], les néoplasies myéloprolifératives (NMP) et les lymphomes anaplasiques à grandes cellules ALK positifs (LAGC ALK+) [4–6]. Nous développons nos thématiques à la fois dans des lignées cellulaires et dans des cellules primaires de patients :
-comment l’autophagie oriente le devenir des cellules tumorales sous thérapie (cytoprotection ou cytotoxicité) ?
Nous avons tout d’abord mis en évidence l’activation d’une autophagie cytotoxique dans les cellules de LAM exprimant l’oncogène tyrosine kinase FLT3-ITD traitées au Bortezomib (inhibiteur du protéasome) [2]. Dans une autre hémopathie maligne : les LAGC ALK+, nous avons au contraire montré que le Crizotinib (inhibiteur de l’activité tyrosine kinase de l’oncogène NPM-ALK) induisait une autophagie cytoprotectrice [4]. Enfin, une étude en cours dans des cellules de néoplasies myéloprolifératives (NMP), présentant la mutation activatrice de l’oncogène JAK2 (V617F), suggère que le Ruxolitinib (inhibiteur de JAK1/JAK2) induit également une autophagie cytoprotectrice dans ces cellules. Dans ces deux derniers exemples, inhiber l’autophagie en combinaison avec ces inhibiteurs de tyrosine kinase représenterait une option thérapeutique potentielle dans ces pathologies.
-l’identification de régulateurs (protéines et ARN) de la réponse autophagique.
Nos travaux nous ont permis d’identifier le facteur de transcription ATF4 dans les LAM en aval de l’oncogène tyrosine kinase FLT3-ITD [3], ainsi que la protéine BCL-2 dans les LAGC ALK+ traités par le Crizotinib [6]. Actuellement, nous approfondissons ces résultats par la compréhension des mécanismes de régulation (facteurs de traduction / microARNs) de ces acteurs de l’autophagie.
-le rôle de l’autophagie dans la régulation de la signalisation, selon le concept original qui consiste à considérer les autophagosomes comme une nouvelle plateforme de signalisation.
-l’utilisation des autophagosomes pour le développement de vaccins anti-tumoraux.
Nous étudions notamment si des autophagosomes isolés à partir de cellules de LAGC ALK+ pourraient servir de « carriers d’antigènes tumoraux », pour stimuler une réponse immunitaire anti-ALK.
Ainsi, nos travaux ont pour vocation de mieux comprendre le rôle, la régulation, la modulation et l’utilisation thérapeutique de l’autophagie afin d’améliorer le traitement de ces hémopathies malignes. Nous bénéficions pour cela d’aides de La Ligue Nationale contre le Cancer, de la Fondation ARC, du Cancéropole GSO et de l’Europe (Programme Recherche et Innovation Marie Sklodowska-Curie) et nous encadrons des étudiants inscrits à l’école doctorale de Biologie/Santé de Toulouse.
Figure descriptive
Publications
1. Joffre, C.; Djavaheri-Mergny, M.; Pattingre, S.; Giuriato, S. L’autophagie: le yin et le yang des cancers. Medecine/Sciences 2017, 33, 328–334, doi:10.1051/medsci/20173303021.
2. Larrue, C.; Saland, E.; Boutzen, H.; Vergez, F.; David, M.; Joffre, C.; Hospital, M. A.; Tamburini, J.; Delabesse, E.; Manenti, S.; Sarry, J. E.; Recher, C. Proteasome inhibitors induce FLT3-ITD degradation through autophagy in AML cells. Blood 2016, 127, 882–892, doi:10.1182/blood-2015-05-646497.
3. Heydt, Q.; Larrue, C.; Saland, E.; Bertoli, S.; Sarry, J.-E.; Besson, A.; Manenti, S.; Joffre, C.; Mansat-De Mas, V. Oncogenic FLT3-ITD supports autophagy via ATF4 in acute myeloid leukemia. Oncogene 2017, doi:10.1038/onc.2017.376.
4. Mitou, G.; Frentzel, J.; Desquesnes, A.; Le Gonidec, S.; AlSaati, T.; Beau, I.; Lamant, L.; Meggetto, F.; Espinos, E.; Codogno, P.; Brousset, P.; Giuriato, S. Targeting autophagy enhances the anti-tumoral action of crizotinib in ALK-positive anaplastic large cell lymphoma. Oncotarget 2015, 6, 30149–30164, doi:10.18632/oncotarget.4999.
5. Frentzel, J.; Sorrentino, D.; Giuriato, S. Targeting autophagy in ALK-associated cancers. Cancers (Basel). 2017, 9 (12),161-180.
6. Torossian, A.; Frentzel, J.; Daugrois, C.; Broin, N.; Gandarillas, S.; Al Saati, T.; Lamant, L.; Brousset, P.; Giuriato, S.; Espinos, E. Blockade of crizotinib-induced BCL-2 elevation in ALK-positive ALCL triggers autophagy associated with cell death. Haematologica, in revision.
Composition de l'équipe
Charly Courdy, Etudiant M2R, charly.courdy@inserm.fr
Véronique De Mas, MCU-PH, DeMas.Veronique@iuct-oncopole.fr
Sylvie Giuriato, CR, INSERM, sylvie.giuriato@inserm.fr
Carine Joffre, CR, INSERM, carine.joffre@inserm.fr
Stéphane Manenti, DR2, CNRS, stephane.manenti@inserm.fr
Domenico Sorrentino, Etudiant en thèse, domenico.sorrentino@inserm.fr