Biochimie Membranaire et Transport
28 rue du Dr Roux - ParisSite web - thomas.wollert@pasteur.fr -
Responsable d'équipe
Thomas Wollert

Thématiques de recherche
Notre travail de recherche a pour objectif de mieux comprendre les mécanismes moléculaires de l’autophagie et d’étudier ses dysfonctionnements lors du processus de dégradation qui accompagne ces maladies. Nous utilisons une approche pluridisciplinaire qui intègre la biologie cellulaire et physique, la biologie quantitative, la biochimie et la microscopie à haute résolution.
Le cytoplasme des cellules eucaryotes contient de nombreux organites (mitochondries, réticulum endoplasmique, appareil de Golgi…) aux fonctions précises et spécialisées. Parmi ceux-ci, les lysosomes sont des stations de recyclage, qui contiennent de nombreuses enzymes hydrolytiques. Ainsi, les lysosomes sont en charge de dégrader de façon spécifique les organites non fonctionnels et les agrégats protéiques (ou Cargo) afin d’éviter leur accumulation dans la cellule.
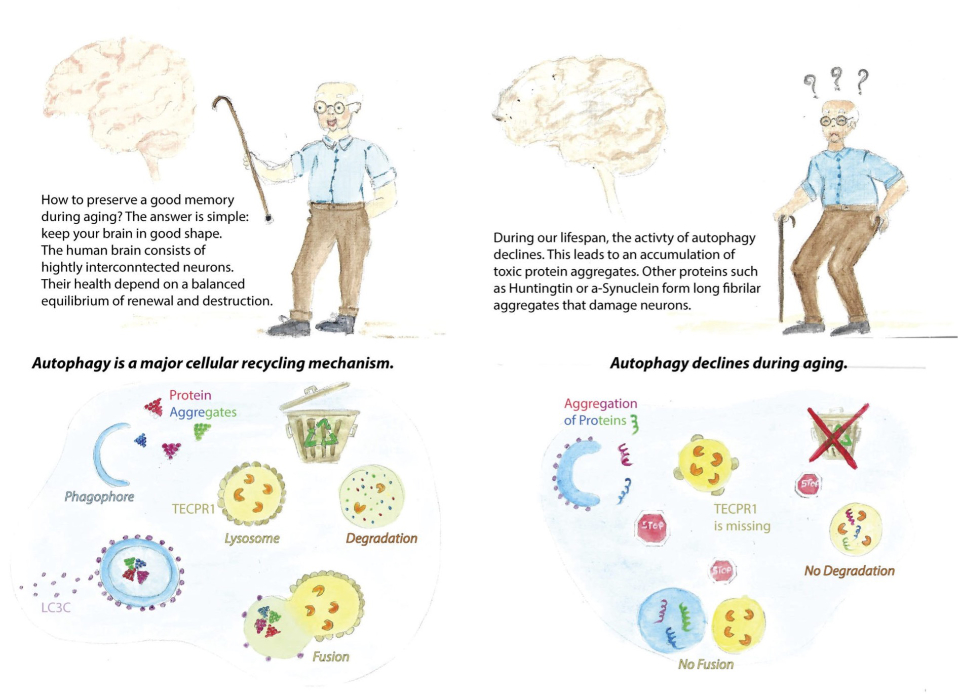
Le transport de matériel cytoplasmique vers les lysosomes est réalisé par un mécanisme appelé autophagie (du grec αυτο : « soi-même », et φαγειν « manger »).
Comment les cellules recyclent-elles leur matériel cytoplasmique ?
L’acheminement du Cargo (organites ou agrégats destinés à la dégradation) depuis le cytoplasme jusqu’aux lysosomes est un processus multi-étapes. Son initiation consiste en la formation d’une structure membranaire ayant l’aspect d’une coupe, qui, par expansion, séquestre le Cargo dans une vésicule bi-membranaire appelée autophagosome. A maturation, l’autophagosome fusionne avec le lysosome et libère son contenu pour sa dégradation.
L’autophagie permet le renouvellement cellulaire et est essentielle pour le maintien de l’homéostasie. Par conséquent, des troubles de l’autophagie peuvent être à l’origine de nombreuses maladies neurodégénératives chez l’homme, telles que les maladies d’Alzheimer, de Parkinson et de Huntington.
Figure descriptive
Publications
Wetzel, L., Blanchard, S., Rama, S., Beier, V., Kaufmann, A. & Wollert, T. (2020) TECPR1 promotes aggrephagy by direct recruitment of LC3C autophagosomes to lysosomes. Nat. Commun. 11, 2993.
Matscheko N, Mayrhofer P, Rao Y, Beier V & Wollert T. (2019) Atg11 tethers Atg9 vesicles to initiate selective autophagy. PLoS Biol. 29;17(7):e3000377.
Moparthi, S.B. & Wollert, T. (2018) Reconstruction of destruction – reconstitution methods in autophagy research, J. Cell. Sci., 132 (4).
Rao, Y., Perna, M.G., Hofmann, B., Beier, V. & Wollert, T. (2016) The Atg1-kinase complex tethers Atg9-vesicles to initiate autophagy. Nat. Commun., 12 (7), 10338. doi: 10.1038/ncomms10338.
Kaufmann, A., Beier, V., Franquelim, H.G. & Wollert, T. (2014) Molecular Mechanism of autophagic membrane-scaffold assembly and disassembly. Cell, 156, 469-481.
Wollert, T. & Hurley, J. H. (2010). Molecular Mechanism for Multivesicular Body Biogenesis by the ESCRT Complexes. Nature, 464, 864-869.
Wollert, T., Wunder, C., Lippincott-Schwartz, J. & Hurley, J. H. (2009). Membrane scission by the ESCRT-III complex. Nature, 458, 172-177.
Wollert, T., Pasche, B., Rochon, M., Deppenmeier, S., van den Heuvel, J., Gruber, A.D., Heinz, D.W., Lengeling, A. & Schubert, W.-D. (2007). Extending the host range of Listeria monocytogenes by rational protein design. Cell, 129, 801-902.
Composition de l'équipe
Stéphane Blanchard, technicien
Daniele Campisi, postdoc
Christine Girard-Blanc, ingénieure
Jagan Mohan, postdoc
Sophie Murtici, assistante administrative
Puck Norell, étudiante PhD
Saloni Partel, postdoc
Sowmya Rama, postdoc