Laboratoire de Biologie Moléculaire et Cellulaire du Cancer
Hôpital Kirchberg9, Rue Edward Steichen
L-2540 Luxembourg - Luxembourg
Site web - marc.diederich@lbmcc.lu -
Responsable d'équipe
Pr Marc Diederich PhD, directeur du LBMCC

Thématiques de recherche
Le Laboratoire de Biologie Moléculaire et Cellulaire du Cancer (LBMCC) se concentre sur l’étude des mécanismes moléculaires impliqués dans le cancer, l’inflammation et l’immunogénicité, dans les tumeurs solides et hématologiques. Parmi différentes approches mécanistiques, nous nous intéressons au rôle et à la modulation de l’autophagie dans les mécanismes de mort et de différenciation cellulaire (1-4) :
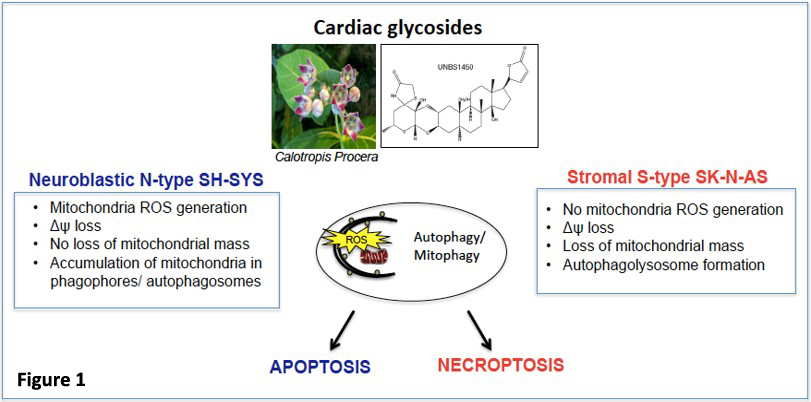
Nous identifions des biomarqueurs et des voies de régulation du renouvellement mitochondrial par mitophagie ou du flux autophagique dans les cellules cancéreuses. Notre étude est axée sur les stratégies anticancéreuses basées sur le ciblage spécifique des mitochondries dérégulées dans les neuroblastomes afin de définir des biomarqueurs et de prédire la réponse aux traitements. Nous visons d’identifier de nouvelles thérapies plus efficaces et des combinaisons thérapeutiques personnalisées pour les sous-groupes de neuroblastomes à haut risque. La mitophagie a été identifiée comme un paramètre clé de l’activités anticancéreuse des glycosides cardiaques dans différents sous-types de neuroblastomes. Nous avons démontré que le glycoside cardiaque hémi-synthétique UNBS1450 exerce ses activités anticancéreuses par une induction précoce de la mitophagie en réponse à un stress mitochondrial sévère, favorisant à son tour la disparition de certains types de cellules (5) (Figure 1).
Par ailleurs, notre objectif est de prédire les marqueurs cellulaires et les voies contrôlant le flux autophagique ainsi que les composés pharmacologiques agissant comme de perturbateurs de l’autophagie. Nous étudions l’effet de sensibilisation des cellules cancéreuses à la mort cellulaire par l’autophagie après l’action ciblée de nouveaux composés synthétiques ou purifiés, y compris en combinaisons, sur différents modèles de cellules cancéreuses. Récemment nous nous sommes particulièrement intéressés à une nouvelle classe d’agents dérivés des polysulfanes issus de l’ail, affectant les microtubules dans des cellules de cancer du côlon avec différents profils génétiques (6). Nous avons également étudié l’inhibition du flux autophagique par les glycosides cardiaques (7-9). Récemment, nous avons montré que la modulation de l’autophagie était corrélée au profil génétique de certains sous-types de cancer du poumon, suggérant une meilleure stratification des patients (10).
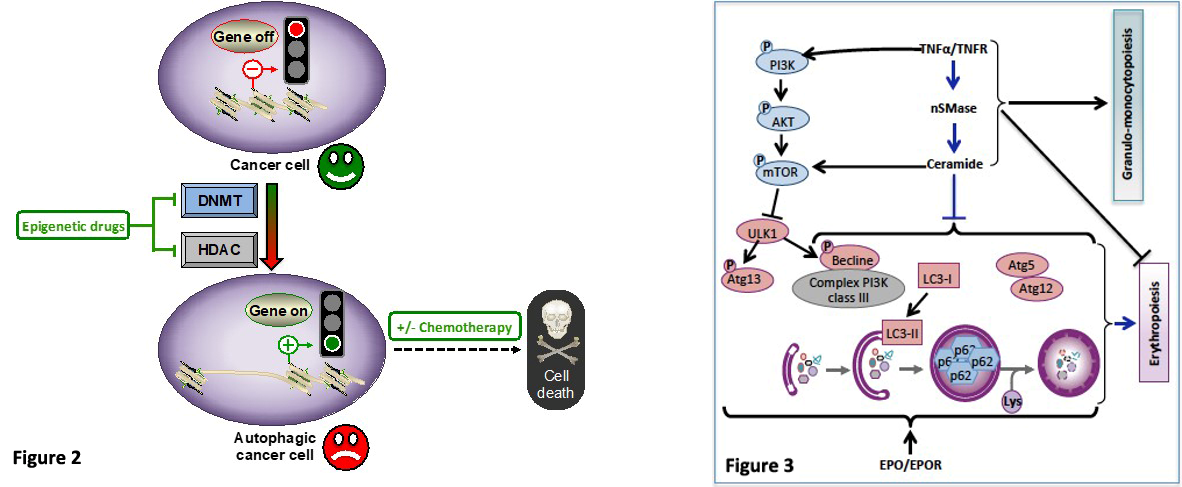
De plus, concernant la modulation pharmacologique de l’autophagie, nous avons identifié des cibles épigénétiques en tant que nouvelle stratégie anticancéreuse. Les mécanismes épigénétiques sont fortement impliquées dans l’autophagie et par conséquent ont le potentiel d’influencer la balance entre mort et survie cellulaires liée à l’autophagie. Des altérations des modifications épigénétiques sont associées à la dérégulation des mécanismes de l’autophagie et à l’apparition de cancers (4). Pour cette raison, nous reprogrammons les cellules tumorales avec des médicaments épigénétiques tels que les inhibiteurs de méthyltransférases de l’ADN (DNMT) et / ou de désacétylases d’histones (HDAC) utilisés seuls ou en combinaison avec d’autres agents chimiothérapeutiques pour interférer avec les flux autophagiques, dans le but de générer une activité anticancéreuse (Figure 2). Par exemple, nous avons montré qu’une exposition prolongée des cellules de la leucémie myéloïde chronique (LMC) à la 5-aza-2’-désoxycytidine, un agent hypométhylant approuvé en clinique, induit l’autophagie et conduit par la suite à une apoptose dépendante des mitochondries. Cette approche thérapeutique sensibilise les cellules de la LMC à l’induction synergique de la mort en combinaison avec des inducteurs d’apoptose classiques ou des inhibiteurs approuvés de HDAC (11). Plus récemment, nous avons identifié un nouvel inhibiteur de DNMT isolé d’une éponge, l’isofistularine-3, qui déclenche l’autophagie des cellules de lymphome et les sensibilise à un inducteur d’apoptose (12, 13). Nos résultats soulignent l’intérêt de moduler l’autophagie dans les cellules cancéreuses pour une approche thérapeutique plus efficace. A long terme, nous souhaiterions mieux comprendre les mécanismes sous-jacents et les déterminants moléculaires de ces traitements dans le but ultime d’offrir de meilleurs choix thérapeutiques pour les patients souffrant d’un cancer (14).
Au-delà de la modulation pharmacologique de l’autophagie, nous caractérisons également les mécanismes cellulaires et moléculaires de l’inhibition de l’érythropoïèse impliquant l’autophagie et conduisant à une anémie de l’inflammation chronique ou du cancer. La cytokine pro-inflammatoire TNFα inhibe l’érythropoïèse et entraine une anémie chez les patients atteints d’un cancer ou d’une maladie inflammatoire chronique (15). L’autophagie joue un rôle essentiel au cours de l’érythropoïèse (16). Nous avons étudié l’impact de la voie pro-inflammatoire TNFα/céramides sur l’autophagie dans des cellules souches hématopoïétiques (CSH) CD34+ stimulées par l’érythropoïétine. Nous montrons que le TNFα et les céramides inhibent l’érythropoïèse reproduite in vitro en corrélation avec l’inhibition de la formation des autophagosomes, l’induction de la phosphorylation de mTORS2448/ULK1S758, l’inhibition de la phosphorylation d’Atg13S355 et de la formation de punctae GFP-LC3. De plus, la voie TNFα/céramide inhibe l’expression de bécline 1 et la formation du complexe Atg5-Atg12. Simultanément, la différenciation granulocytaire des CSH est activée. La bafilomycine A1 (Baf) et un siRNA anti-Atg5, bloquent l’érythropoïèse alors que seule la Baf induit la granulopoïèse. En revanche, la rapamycine prévient l’inhibition de l’érythropoïèse par le TNFα et les céramides, au détriment de la différenciation granulocytaire. Ces résultats démontrent que la voie TNFα/céramides joue un rôle dans l’homéostasie hématopoïétique par l’inhibition de l’érythropoïèse au profit de la myélopoïèse, en impactant les étapes tardives de l’autophagie (Figure 3) (17).
Figure descriptive
Publications
(1) Cerella C., et al., Biotechnol Adv, 2014, 10.1016/j.biotechadv.2014.03.006
(2) Diederich M. and Cerella C., Semin Cancer Biol, 2016, 10.1016/j.semcancer.2016.06.001
(3) Morceau F., et al., Biotechnol Adv, 2015, 10.1016/j.biotechadv.2015.03.013
(4) Schnekenburger M., et al., Biotechnol Adv, 2014, 10.1016/j.biotechadv.2014.03.009
(5) Radogna F., et al., Oncogene, 2016, 10.1038/onc.2015.455
(6) Yagdi Efe E., et al., Cancer Lett, 2017, 10.1016/j.canlet.2017.09.011
(7) Diederich M., et al., Biochem Pharmacol, 2017, 10.1016/j.bcp.2016.08.017
(8) Juncker T., et al., Biochem Pharmacol, 2011, 10.1016/j.bcp.2010.08.025
(9) Cerella C., et al., Cell Death Dis, 2015, 10.1038/cddis.2015.134
(10) Schneider N. F. Z., et al., Front Pharmacol, 2018, 10.3389/fphar.2018.00070
(11) Schnekenburger M., et al., Biochem Pharmacol, 2011, 10.1016/j.bcp.2010.10.013
(12) Florean C., et al., Mar Drugs, 2018, 10.3390/md16120518
(13) Florean C., et al., Oncotarget, 2016, 10.18632/oncotarget.8210
(14) Radogna F., et al., Biochem Pharmacol, 2015, 10.1016/j.bcp.2014.12.018
(15) Chateauvieux S., et al., Biochem Pharmacol, 2011, 10.1016/j.bcp.2011.06.045
(16) Orsini M., et al., Biochem Pharmacol, 2018, 10.1016/j.bcp.2018.04.007
(17) Orsini M., et al., Cell Death Differ, 2018, 10.1038/s41418-018-0245-x
Composition de l'équipe
Dr Franck Morceau, PhD, chef d’équipe, franck.morceau[at]lbmcc.lu
Dr Claudia Cerella, PhD, chef d’équipe, claudia.cerella[at]lbmcc.lu
Dr Michael Schnekenburger, PhD, chef d’équipe, michael.schnekenburger[at]lbmcc.lu
Dr Flavia Radogna, PhD, postdoc, flavia.radogna[at]lbmcc.lu
Dr Cristina Florean, postdoc, cristina.florean[at]lbmcc.lu
Dr Esma Yagdi, PhD, ancienne doctorante
Dr Marion Orsini, PhD, ancienne doctorante