Régulation hormonale du développement et des fonctions du cerveau
INSERM, U1151Institut Necker Enfants-Malades
14 rue Maria Helena Vieira Da Silva
75014 Paris, France - Paris
Site web - franck.oury@inserm.fr -
Responsable d'équipe
Franck Oury

Thématiques de recherche
Notre laboratoire s’intéresse de longue date aux rôles des facteurs hormonaux dans la régulation des fonctions cognitives et métaboliques du cerveau. Les hormones sont des facteurs essentiels au maintien de nos fonctions physiologiques en assurant le dialogue entre les organes. Leur large spectre d’actions ne se limite pas aux organes périphériques. Certains facteurs hormonaux, tels que la leptine, l’insuline, les hormones thyroïdiennes et les hormones stéroïdiennes atteignent le SNC où ils influencent l’homéostasie neuronale, la neurogenèse adulte et les fonctions cognitives et métaboliques. De nombreuses études suggèrent également que les déséquilibres hormonaux apparaissant pendant le vieillissement pourraient contribuer au déclin progressif des fonctions cognitives au cours de l’âge. Cependant, bien que l’importance fonctionnelle des facteurs hormonaux sur les activités cérébrales est indéniable, les mécanismes cellulaires et moléculaires médiant leurs actions au sein des neurones restent encore largement inconnu. De plus, bien que le cerveau exprime les récepteurs pour la plupart des facteurs hormonaux, si ce n’est pas tous, le rôle de nombreuses hormones au niveau central reste encore inexploré. Par conséquent, une meilleure compréhension de l’influence de l’homéostasie hormonale sur les neurones et les fonctions cérébrales est aujourd’hui essentiel et pourrait ouvrir de nouvelles perspectives thérapeutiques visant à atténuer les déficiences cognitives liées au vieillissement physiologique.
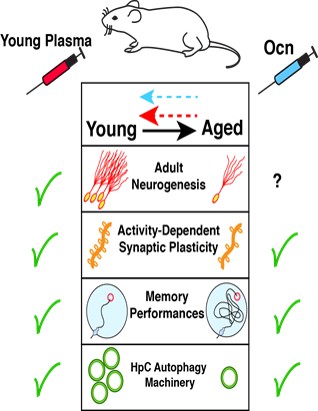
Contexte: De récentes études indiquent que l’administration de plasma jeune (YP) améliore la mémoire chez les souris âgées (Fig. 1). Ceci suggère le rôle clé des facteurs systémiques dans le maintien des fonctions cognitives (i.e mémoire) et de la plasticité cérébrale au cours de l’âge. Conformément à ces résultats, nous avons pu identifié, qu’ostéocalcine (Ocn), une hormone produite par l’os, est un facteur circulant capable de rajeunir les fonctions de la mémoire hippocampique-dépendante (HpC) chez la souris âgée (Fig. 1). Ocn traverse la barrière hémato-encéphalique et a un impact sur la mémoire et l’homéostasie neuronale en modulant la production et le trafic de facteur neurotrophique dérivé du cerveau (BDNF), via l’activation de son récepteur : GPR158, présent sur les neurones HpC. Les niveaux d’Ocn circulants sont considérablement réduits chez les souris âgées, et une restauration des niveaux d’Ocn dans les souris âgées est nécessaire et suffisante pour améliorer les déficits cognitifs liés à l’âge (Khrimian et al., J. Exp. Med. 2017 ; Obri et al., Nature Review Endo. 2018). Les effets thérapeutiques potentiels de l’exposition à des facteurs systémiques «jeunes», tels que Ocn, pour remédier aux altérations de la mémoire associées au vieillissement, soulèvent une question cruciale : quels sont les effecteurs intracellulaires des facteurs de rajeunissement dans les neurones HpC? Dans ce contexte, nous avons observé que les injections de YP / Ocn chez de vieilles souris augmentaient les niveaux de HpC de diverses protéines ATG.
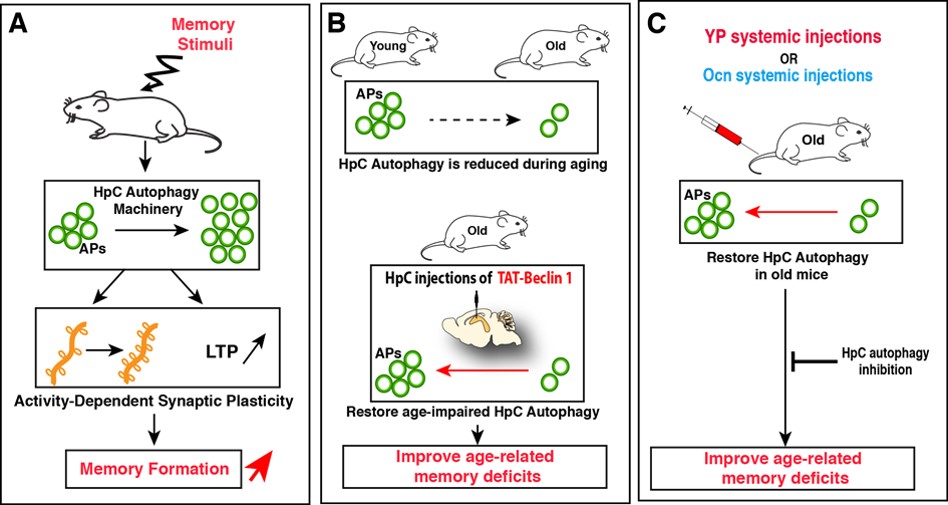
Une perturbation de l’autophagie est associée à de nombreuses maladies neurodégénératives. Cependant, bien que les fonctions cognitives et l’autophagie diminuent avec l’âge, le rôle physiologique de l’autophagie dans le contrôle des fonctions cognitives, la plasticité cérébrale et le déclin de la mémoire lié à l’âge n’ont pas encore été établis. Étant donné que les autophagosomes sont activement formés dans les synapses et que les neurones de l’hippocampe sont fortement influencés par divers facteurs environnementaux, nous avons entrepris d’explorer le rôle de l’autophagie dans la régulation et le maintient de la mémoire au cours du vieillissement physiologique du cerveau, mais aussi et surtout en tant que médiateur potentiel des effets des facteurs systémiques sur la mémoire et la plasticité cérébrale.
En utilisant différents modèles de souris dérégulés pour l’autophagie sélectivement dans les neurones HpC, nous avons constaté que ces souris avaient des capacités de mémoire altérées. Nous avons ensuite montré que l’autophagie était rapidement induite dans les neurones HpC après exposition à de nouveaux stimuli de mémoire et que cette induction est un mécanisme nécessaire à la formation de nouvelles mémoires, en favorisant la plasticité synaptique structurelle et fonctionnelle dans les neurones de l’hippocampe (Fig. 2A). Nous avons ensuite constaté que l’activité autophagique est réduite au sein de l’HpC au cours du vieillissement et que la restauration de son niveau est suffisante pour améliorer les déficits de mémoire liés à l’âge (Fig. 2B). Enfin, nous avons observé que l’injection de YP dans les souris âgées améliore au sein des neurones HpC, les altérations du niveau d’autophagie liés à l’âge, mais aussi et surtout que les effets bénéfiques de l’administration de YP sur le déclin des fonctions cognitives et de la plasticité neuronale sont abrogés après dérégulation sélective de l’autophagie au sein de l’HpC (Fig. 2C). Parmi ces facteurs, nous avons montré qu’Ocn est un facteur hormonal régulant le processus d’autophagie au sein des neurones HpC (Glatigny et al., Current Biol. 2019).
En résumé, nos résultats révèlent une nouvelle fonction physiologique de l’autophagie au sein du cerveau favorisant la formation de nouvelles mémoires. Nos résultats indiquent également que la diminution de l’activité autophagique avec l’âge contribue activement au déclin progressif des fonctions cognitives au cours du vieillissement, mais aussi et surtout qu’une modulation pharmacologique de l’autophagie pourrait être considérée comme une nouvelle approche thérapeutique dans le traitement des troubles cognitifs liés à l’âge. Enfin, cette étude met en évidence un rôle clé de l’autophagie dans la communication entre le milieu systémique et les neurones favorisant le maintien de l’homéostasie neuronale et des fonctions cognitives au cours de la vie.
Figure descriptive
Publications
– Glatigny M, Moriceau S, Rivagorda M, Ramos-Brossier M, Nascimbeni AC, Lante F, Boudarene N, Friedman AK, Kuperwasser N, Friedlander G, Buisson A, Morel E, Codogno P, and Oury F*. Autophagy is required for memory formation and reverses age-related memory declines. Current Biology. 2019. 29(10):1-14.
– Obri A, Khrimian L, Karsenty G, Oury F*. Osteocalcin in the brain: from embryonic development to age-related decline in cognition. Nat. Rev. Endocrinol. 2018. 14(3):174-182.
– Khrimian L, Obri A, Ramos-Brossier M, Rousseaud A, Moriceau S, Mera P, Kosmidis S, Karnavas T, Gao XB, Oury F*, Kandel E, and Karsenty G*. Gpr158 mediates osteocalcin’s regulation of cognition. J Exp Med. 2017. 214(10):2859-73.
– Oury F, Khrimian L, Gardin A, Chamouni A, Goeden N, Huang Y, Lee H, Srinivas P, Gao XB, Suyama S, Mann JJ, Horvath T, Bonnin A, Karsenty G. Maternal and offspring pools of osteocalcin influence brain development and functions. Cell. 2013.155(1):228-41.
– Oury F, Sumara G, Sumara O, Ferron M, Chang H, Smith C.E, Hermo l, Suarez S, Roth B.L, Ducy P, Karsenty G. Endocrine regulation of male fertility by skeleton. Cell. 2011. 144(5):796-809.
– Oury F, Murakami Y, Renaud JS, Pasqualetti M, Charnay P, Ren SY, and Rijli FM. Hoxa2- and Rhombomere-Dependent Development of the Mouse Facial Somatosensory Map. Science. 2006. 313(5792):1408-13.
Composition de l'équipe
Franck OURY, chef d’équipe (franck.oury[at]inserm.fr)
Anne-Sophie ARMAND, MCU (anne-sophie.armand[at]inserm.fr)
Stéphanie MORICEAU, postdoc (stephanie.moriceau[at]inserm.fr)
Eleni SIOPI, postdoc (eleni.siopi[at]inserm.fr)
Mariana RAMOS-BROSSIER, postdoc (mariana.ramos[at]inserm.fr)
David GUITART, postdoc (david.guitart[at]inserm.fr)
Manon RIVAGORDA, PhD doctorante (manon.rivagorda[at]inserm.fr)
Valérie BOITEZ, ingénieur (valerie.boitez[at]inserm.fr)
François MAILLIET, ingénieur (francois.mailliet[at]inserm.fr)
Alexandre CHAMOUNI, Clinicien (alexandre.chamouni[at]inserm.fr)