Lipness : Lipoproteines et transferts lipidiques dans l’inflammation stérile et septique
UFR des Sciences de Santé7 Bd Jeanne d’arc - Dijon
Site web - david.masson@u-bourgogne.fr - 0380393352
Responsable d'équipe
David MASSON, PU-PH

Thématiques de recherche
Réponse mitophagie et inflammatoire (Chercheurs principaux: C.THOMAS, P.E. CHARLES, M BLOT)
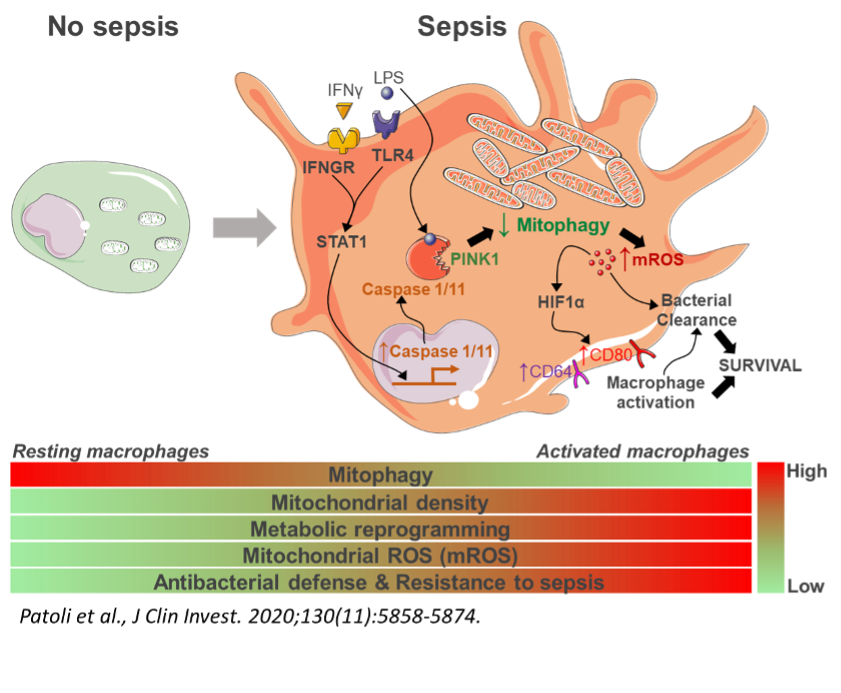
La mitophagie est une autophagie dédiée aux mitochondries permettant l’élimination des mitochondries endommagées dans les cellules. Nos recherches visent à identifier les voies de signalisation résultant de l’inhibition de la mitophagie par le LPS et l’IFNγ dans les macrophages. Nous étudions si cette inhibition de la mitophagie se produit dans les macrophages et les neutrophiles polynucléaires dans le contexte d’infections bactériennes telles que les septicémies ou des modèles expérimentaux de pneumonie et nous explorons si la modulation de la mitophagie peut affecter les réponses inflammatoires et bactéricides.
Nos travaux ont récemment mis en évidence que l’activation de la voie de signalisation STAT1 conduit à l’inhibition de la mitophagie dans les cellules myéloides en induisant une dégradation de la protéine PINK1 dépendante des caspases inflammatoires 1 et 11. Cette inhibition de la mitophagie s’avère être un facteur protecteur contre le sepsis induit par les bactéries gram négatif. Nous avons pu faire la preuve de concept du potentiel thérapeutique de cette découverte à l’aide de modulateurs pharmacologiques de la mitophagie. Nous avons également mis en évidence son potentiel diagnostique en tant que biomarqueurs du sepsis (Patoli et al. , JCI, 2020). Nous poursuivons actuellement plusieurs projets dans la continuité de ses travaux aussi bien dans le champ de l’inflammation septique (sepsis et choc septique) et de l’inflammation stérile (athérosclérose et vieillissement).
Inflammation septique : 1) Etude clinique MIMIC visant à étudier la mitophagie dans les cellules myéloïdes chez les patients de réanimation médicale avec ou sans sepsis. 2) Projet de valorisation visant à vectoriser des modulateurs pharmacologiques de la mitophagie afin de moduler spécifiquement l’activation des macrophages et leur réponse inflammatoire.
Inflammation stérile : Projet ANR STATmiNADage (collaboration avec le Prof. J. Auwerx, EPFL, Lausanne) visant à étudier l’interaction entre la voie de signalisation STAT1, la mitophagie et le métabolisme du NAD dans les cellules myéloides dans l’athérosclérose lié au vieillissement.
Autres principaux axes de recherche de l’équipe Lipness
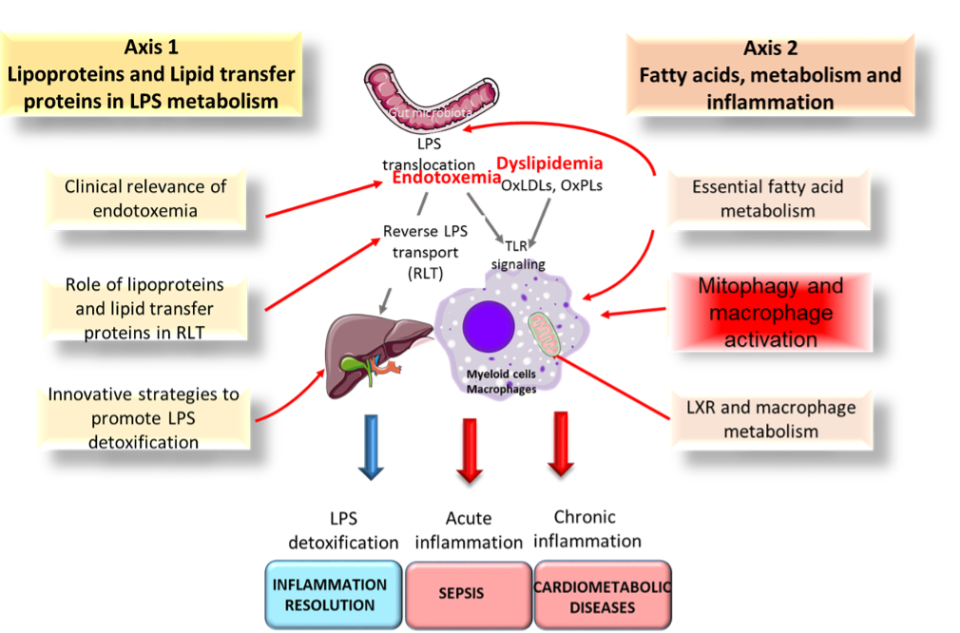
Exploration du rôle des lipoprotéines dans la voie de transport reverse des lipopolysaccharides (RLT) (Chercheurs principaux: L.LAGROST, V.DECKERT, T.GAUTIER, M NGUYEN)
Les lipopolysaccharides (LPS) se lient et activent le récepteur TLR4 à la surface des cellules immunitaires, conduisant à la libération de cytokines pro-inflammatoires et à l’inflammation. Alternativement, les blebs bactériens formant de larges agrégats de LPS peuvent être dégradés via notamment le transfert de molécules de LPS vers les lipoprotéines. Ce processus entraîne la neutralisation du LPS et son élimination vers le foie. Des observations récentes suggèrent que la PLTP et la CETP, en tant que membres de la famille des protéines de transfert de lipides et des lipopolysaccharides, jouent un rôle moteur dans le RLT, modulant ainsi l’inflammation et l’immunité innée.
Rôle des acides biliaires dans la neutralisation / détoxification du LPS (Chercheurs principaux: (S. MANDARD, T. GAUTIER)
Les molécules de LPS sont éliminées de l’organisme par excrétion biliaire lors de l’étape finale de la voie de transport inverse du LPS. Alors que certains travaux antérieurs ont documenté l’interaction biophysique des endotoxines avec des acides biliaires purifiés, les conséquences physiopathologiques de cette interaction en termes de capacité pro-inflammatoire et de nutralisation du LPS ne sont pas complétement élucidées. Nous visons à mieux comprendre le lien entre le métabolisme des acides biliaires et la neutralisation / détoxification du LPS.
Etudes de l’endotoxémie dans différentes populations humaines et conséquences physiopathologiques dans la septicémie et le choc septique (Chercheurs principaux (J.P. QUENOT, B. BOUHEMAD, L.LAGROST)
L’incidence des septicémies sévères et des chocs septiques au seins des unités de soins intensifs est d’environ 15% et la mortalité hospitalière associées est de 25% et 49%, respectivement. Malgré des avancées significatives dans notre compréhension de la physiopathologie de la septicémie sévère et du choc septique, les tentatives de traduire ces résultats par de nouveaux traitements et par une amélioration du pronostic des patients restent décevantes. L’un des principaux objectifs de l’équipe Lipness est de déterminer dans quelle mesure la neutralisation et l’élimination du LPS pourrait constituer une nouvelle approche pertinente pour améliorer le pronostic clinique du choc septique.
Rôle du GLP-1 et de l’insuline dans la réponse inflammatoire médiée par le LPS (Investigateur principal: J.GROBER)
Chez des sujets sains, une endotoxémie modérée a été associée, à court terme, à une sensibilité accrue à l’insuline tandis qu’une résistance à l’insuline peut survenir à de manière plus tardive. Nous avons récemment montré que le LPS est capable d’augmenter les niveaux circulants de Glucagon Like Peptide-1 (GLP-1), une incrétine impliquée dans la sécrétion d’insuline stimulée par le glucose (GSIS).
Modulation du métabolisme des acides gras dans les macrophages et inflammation (Chercheurs principaux: D.MASSON, C. THOMAS)
Les phospholipides sont continuellement remodelés par déacylation et réacylation du fait des actions opposées des phospholipases A2 et des lysophospholipides acyl-transférases (LPLAT). Les LPLAT affectent à la fois la teneur en acides gras polyinsaturés des phospholipides et la disponibilité des acides gras libres tels que l’acide arachidonique utilisé pour la synthèse des eicosanoïdes. En utilisant des modèles de souris spécifiques et des échantillons de patients humains, nous évaluons l’impact du métabolisme des phospholipides et des acides gras dans les cellules myéloïdes sur le développement de l’inflammation et de l’athérosclérose.
Acides gras polyinsaturés et inflammation: comprendre le rôle des AGPI dans le contexte de l’obésité (Chercheurs principaux: J. BELLENGER, S. BELLENGER, M. NARCE).
Les acides gras N-3 sont connus pour limiter le développement de l’obésité, mais les mécanismes moléculaires ne sont pas entièrement élucidés. Une diminution du rapport n-6 / n-3 via des régimes enrichis en acides gras n-3 peut exercer des effets bénéfiques sur l’obésité et la résistance à l’insuline dans des modèles de rongeurs. Nos objectifs sont de déterminer si une teneur élevée en acides gras n-3 peut protéger contre l’obésité alimentaire en atténuant l’endotoxémie métabolique et de déchiffrer les mécanismes moléculaires impliqués.
Figure descriptive
Publications
1. Deckert V, Lemaire S, Ripoll P-J, de Barros J-PP, Labbé J, Borgne CC-L, Turquois V, Maquart G, Larose D, Desroche N, Ménétrier F, Le Guern N, Lebrun LJ, Desrumaux C, Gautier T, Grober J, Thomas C, Masson D, Houdebine L-M, Lagrost L. Recombinant human plasma phospholipid transfer protein (PLTP) to prevent bacterial growth and to treat sepsis. Sci Rep. 2017;7:3053.
2. Sali W, Patoli D, Pais de Barros J-P, Labbé J, Deckert V, Duhéron V, Le Guern N, Blache D, Chaumont D, Lesniewska E, Gasquet B, Paul C, Moreau M, Denat F, Masson D, Lagrost L, Gautier T. Polysaccharide Chain Length of Lipopolysaccharides From Salmonella Minnesota Is a Determinant of Aggregate Stability, Plasma Residence Time and Proinflammatory Propensity in vivo. Front Microbiol. 2019;10:1774.
3. Nguyen M, Pallot G, Jalil A, Tavernier A, Dusuel A, Le Guern N, Lagrost L, Pais de Barros J-P, Choubley H, Bergas V, Guinot P-G, Masson D, Bouhemad B, Gautier T. Intra-Abdominal Lipopolysaccharide Clearance and Inactivation in Peritonitis: Key Roles for Lipoproteins and the Phospholipid Transfer Protein. Front Immunol. 2021;12:622935.
4. Dargent A, Pais De Barros J-P, Ksiazek E, Fournel I, Dusuel A, Rerole AL, Choubley H, Masson D, Lagrost L, Quenot J-P. Improved quantification of plasma lipopolysaccharide (LPS) burden in sepsis using 3-hydroxy myristate (3HM): a cohort study. Intensive Care Med. 2019;45:1678–1680.
5. Lebrun LJ, Lenaerts K, Kiers D, Pais de Barros J-P, Le Guern N, Plesnik J, Thomas C, Bourgeois T, Dejong CHC, Kox M, Hundscheid IHR, Khan NA, Mandard S, Deckert V, Pickkers P, Drucker DJ, Lagrost L, Grober J. Enteroendocrine L Cells Sense LPS after Gut Barrier Injury to Enhance GLP-1 Secretion. Cell Rep. 2017;21:1160–1168.
6. Ménégaut L, Jalil A, Thomas C, Masson D. Macrophage fatty acid metabolism and atherosclerosis: The rise of PUFAs. Atherosclerosis. 2019;291:52–61.
7. Ménégaut L, Thomas C, Jalil A, Julla JB, Magnani C, Ceroi A, Basmaciyan L, Dumont A, Goff WL, Mathew MJ, Rébé C, Dérangère V, Laubriet A, Crespy V, Barros J-PP de, Steinmetz E, Venteclef N, Saas P, Lagrost L, Masson D. Interplay between Liver X Receptor and Hypoxia Inducible Factor 1α Potentiates Interleukin-1β Production in Human Macrophages. Cell Reports [Internet]. 2020 [cited 2020 May 19];31. Available from: https://www.cell.com/cell-reports/abstract/S2211-1247(20)30618-5
8. Patoli D, Mignotte F, Deckert V, Dusuel A, Dumont A, Rieu A, Jalil A, Van Dongen K, Bourgeois T, Gautier T, Magnani C, Le Guern N, Mandard S, Bastin J, Djouadi F, Schaeffer C, Guillaumot N, Narce M, Nguyen M, Guy J, Dargent A, Quenot J-P, Rialland M, Masson D, Auwerx J, Lagrost L, Thomas C. Inhibition of mitophagy drives macrophage activation and antibacterial defense during sepsis. J Clin Invest. 2020;
9. Blot M, Jacquier M, Pauchard L-A, Rebaud C, Marlin C, Hamelle C, Bataille A, Croisier D, Thomas C, Jalil A, Mirfendereski H, Piroth L, Chavanet P, Bensoussan D, Laroye C, Reppel L, Charles P-E. Adverse Mechanical Ventilation and Pneumococcal Pneumonia Induce Immune and Mitochondrial Dysfunctions Mitigated by Mesenchymal Stem Cells in Rabbits. Anesthesiology. 2022;136:293–313.
10. Bidu C, Escoula Q, Bellenger S, Spor A, Galan M, Geissler A, Bouchot A, Dardevet D, Morio B, Cani PD, Lagrost L, Narce M, Bellenger J. The Transplantation of ω3 PUFA-Altered Gut Microbiota of fat-1 Mice to Wild-Type Littermates Prevents Obesity and Associated Metabolic Disorders. Diabetes. 2018;67:1512–1523.
Composition de l'équipe
CHERCHEURS
MASSON David (PU-PH) HDR*
THOMAS Charles (MCU) – responsable projets mitophagie, Charles.Thomas@u-bourgogne.fr
BELLENGER Jérome (MCU)
BLOT Mathieu (MCUPH)*
BOUHEMAD Bélaid (PUPH) HDR*
BOURGEOIS Thibaut (ater)
CHARLES Pierre-Emmanuel (PU-PH) HDR*
DECKERT Valérie (CR Inserm)*
GAUTIER Thomas (CRCN- INSERM ) HDR*
GROBER Jacques (MCU) HDR
LAGROST Laurent (DR Inserm)
MANDARD Stéphane (MCU)*
NARCE Michel (PU) HDR
QUENOT Jean-Pierre (PUPH) HDR*
GUINOT Pierre-Grégoire (PUPH) HDR
PERSONNELS ITA
BELLENGER Sandrine (IR – uB)
BERGAS Victoria (TR-uB) 50%
BLANCHE Jean-Marc (Adj uB)
JARDEL Honorine (AI INSERM)
LE GUERN Naig (TR – INSERM)*
PAIS DE BARROS Jean-Paul (IR – INSERM) 50%*
PILOT Thomas (IE INSERM)*
PROUKHNITZKY Lil (AI – UBFC)*
ROBLET Loic (adj – uB)
ETUDIANTS ET POST-DOCTORANTS
BENKHALED Anissa (M2R)
BOURRAGAT Amina (PhD 3ème année Inserm)
EL HAMWI Amar (PhD – 1ère année UB)
LE NEINDRE Aymeric (PhD – 3 ème année)
LELEU Damien (post-doc CHU)
LOISEAU Mélanie (PhD – 1ère année CHU)
MEGENAUT Louise (post-doc CHU)
MEUNIER-BEILLARD Nicolas (PhD 2ème année CHU)
NGYEN Maxime (post-doc CHU)*
PALLOT Gaetan (PhD – 3ème année)
VAN DONGEN Kevin (PhD – 3ème année)*
VOUILLOZ Adrien (PhD – 2ème année UBFC)
MANGIN Léa (M2R)*