E3 ligase, cytosquelette et maladies neurodégénératives
INSERM, U1051Institut des Neurosciences de Montpellier
80 rue Augustin Fliche, 34091 Montpellier - Montpellier
Site web - pascale.bomont@inserm.fr -
Responsable d'équipe
Dr Pascale Bomont, chercheuse INSERM

Thématiques de recherche
Notre laboratoire s’intéresse de longue date aux maladies neurodégénératives humaines, et en particulier à une maladie rare appelée Neuropathie à Axones Géants (NAG) (Kuhlenbäumer et al. 2012). Extrêmement sévère, cette neuropathie infantile touche tout le système nerveux et induit une agrégation massive du cytosquelette dans tous les tissus de patients, supposant des rôles essentiels du gène NAG dans des processus biologiques clefs, dans la survie neuronale et l’organisation du cytosquelette.
Avec l’objectif constant d’apporter des réponses aux patients et de dessiner de futures voies thérapeutiques pour cette maladie fatale, notre équipe s’est engagée dans l’étude de NAG, depuis la recherche du locus génétique à l’étude des mécanismes pathologiques, jusqu’à la mise en place de dispositifs pour le diagnostic et la thérapie. Point de départ de l’étude des voies pathologiques engagées dans NAG, notre laboratoire a identifié le gène responsable de la maladie, codant pour une nouvelle ubiquitine E3 ligase appelée Gigaxonine (Bomont et al. 2000). Le développement de modèles cellulaires issus de patients (Cleveland et al. 2009) et la création d’un modèle murin (Ganay et al. 2011) nous ont permis d’étudier les désordres massifs du cytosquelette dans NAG, et de mettre en lumière le rôle fondamental de la Gigaxonine dans le contrôle de la dégradation des Filaments Intermédiaires (Mahammad et al. 2013).
Notre entrée dans le monde de l’autophagie est récente, et débute ici avec l’identification de la Gigaxonine comme un nouvel interrupteur moléculaire des étapes précoces de la voie autophagique (Scrivo et al. 2019).
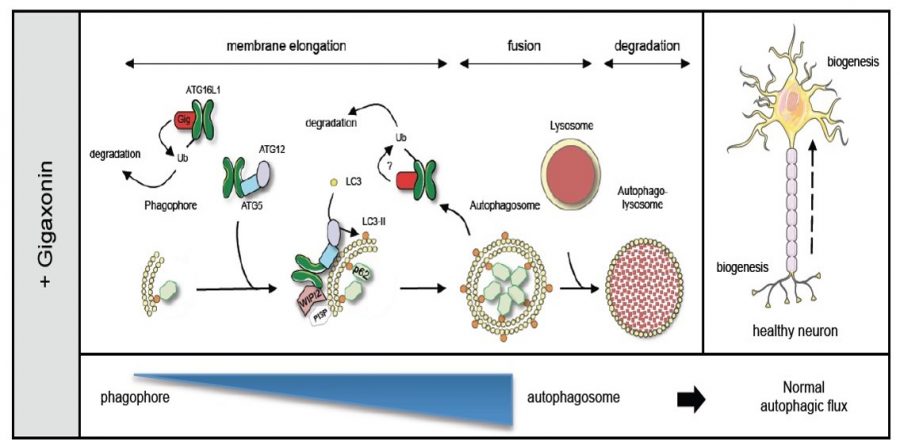
En effet, nous venons de démontrer que la Gigaxonine contrôle la production des autophagosomes, en agissant au niveau de la protéine ATG16L1, qui est un acteur nécessaire à l’élongation des phagophores puisqu’il recrute le complexe ATG12-ATG5 à la membrane, permettant ainsi la lipidation localisée de la protéine LC3. Ainsi, nous révélons que la Gigaxonine intéragit avec le domaine C-terminal WD40 d’ATG16L1 pour induire sa poly-ubiquitination et sa dégradation par les deux voies de dégradation cellulaire.
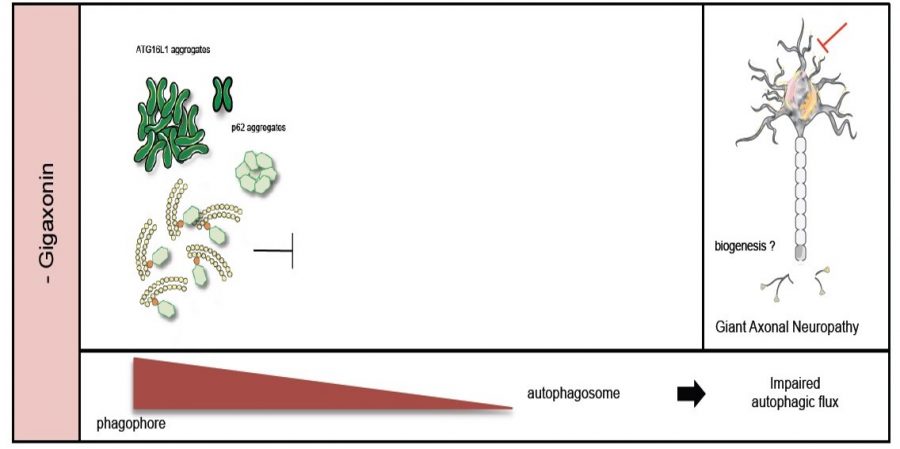
L’étude de neurones corticaux primaires, issus de nos souris NAG-/- nous a permis de révéler qu’en l’absence de Gigaxonine, la protéine ATG16L1 s’accumule dans le soma des neurones, et conduit à un blocage du flux autophagique. Ainsi, les neurones déplétés en Gigaxonine présentent une diminution de la lipidation de LC3, qui correspond à une diminution de la production nette de nouveaux autophagosomes. Résultant de ce défaut, les étapes subséquentes à l’étape d’élongation des autophagosomes sont altérées, à savoir la fusion avec les lysosomes et la dégradation du contenu autophagique.
Restaurés par l’introduction de la Gigaxonin humaine, ces défauts soulignent le rôle fondamental de la Gigaxonine-E3 ligase dans la dynamique de formation des autophagosomes. Ainsi, nos résultats positionnent la Gigaxonine comme un nouvel interrupteur moléculaire pour moduler l’activation de l’autophagie par ATG16L1, et comme une cible thérapeutique pertinente pour de nombreuses maladies humaines. Pour NAG, ces travaux ouvrent de belles perspectives quant à la contribution de cette fonction dans les processus neurodégénératifs, et plus largement, vont permettre d’étudier les fonctions de la voie autophagique localisée dans le soma, domaine qui est encore peu connu.
Figure descriptive
Publications
Kuhlenbäumer G, Timmerman V, Bomont P. (2012) Giant Axonal Neuropathy.
GeneReviews™. Seattle (WA): University of Washington, Seattle; Jun 21.
Bomont P, Cavalier L, Blondeau F, Ben Hamida C, Belal S et al. (2000) The gene encoding gigaxonin, a new member of the cytoskeletal BTB/kelch repeat family, is mutated in giant axonal neuropathy. Nat Genet. 26(3):370-4
Cleveland DW, Yamanaka K, Bomont P. Gigaxonin controls vimentin organization through a tubulin chaperone-independent pathway. Hum Mol Genet. 2009 Apr 15;18(8):1384-94.
Ganay T, Boizot A, Burrer R, Chauvin JP, Bomont P. Sensory-motor deficits and neurofilament disorganization in gigaxonin null mice. Mol Neurodegener. 2011;6:25
Mahammad S, Murthy SN, Didonna A, Grin B, Israeli E et al. Giant axonal neuropathy-associated gigaxonin mutations impair intermediate filament protein degradation. J Clin Invest. 2013 May;123(5):1964-75.
Scrivo A, Codogno P, Bomont P. Gigaxonin E3 ligase governs ATG16L1 turn over to control autophagosome production. Nat Commun 2019 Feb 15;10(1):780.
Composition de l'équipe
Pascale Bomont, chef d’équipe (pascale.bomont(at)inserm.fr)
Karolina Mysiak, postdoc (karolina.mysiak(at)inserm.fr)
David Gonzalez, postdoc (david.gonzalez-figueroa(at)inserm.fr)
Léa Lescouzères, doctorante (lea.lescouzeres(at)inserm.fr)
Nicolas Pradeilles, assistant ingénieur (nicolas.pradeilles(at)inserm.fr)
Caroline Liénard, interne en Pharmacie (caroline.lienard(at)inserm.fr)
Dimitris Karaliu, étudiant ERASMUS