Laboratory de biologie épithéliale
INSERM UMR 1163Institut Imagine
24, Boulevard du Montparnasse
75015 Paris - Paris
Site web - matias.simons@institutimagine.org -
Responsable d'équipe
Matias Simons, Directeur de recherche (INSERM), PI, Liliane Bettencourt

Thématiques de recherche
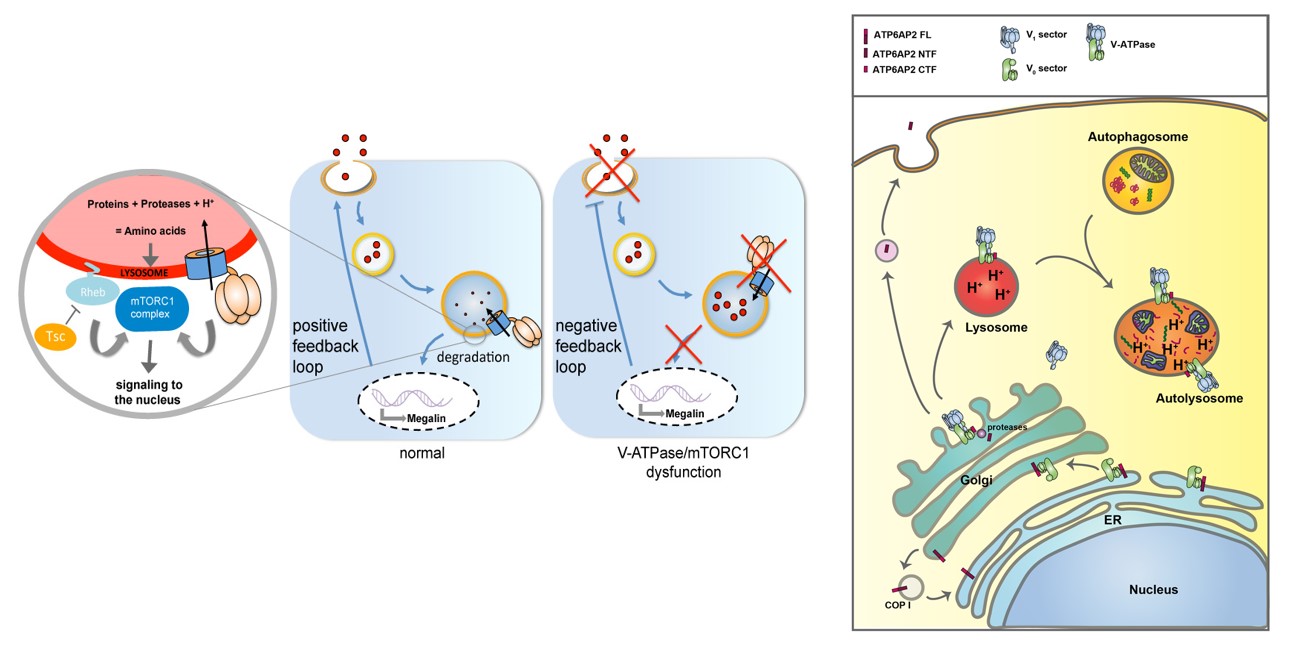
Des mutations dans ATP6AP2 provoquent une maladie hépatique avec altérations autophagiques: Un objectif de longue date du laboratoire est de caractériser fonctionnellement ATP6AP2 (également appelé récepteur de la (pro)rénine). Nos résultats suggèrent que cette protéine contribue à l’assemblage de la pompe à protons V-ATPase dans le réticulum endoplasmique. À travers ce rôle, ATP6AP2 a un impact fondamental sur diverses voies de signalisation (PCP, Wnt, Notch, mTOR, etc.) (Hermle et al, 2010, 2013; Trepiccione et al, 2016; Guida et al, 2018). Nos travaux de recherche ont permis de découvrir que des mutations dans ATP6AP2 causent une maladie hépatique caractérisée par un stéatose hépatique et avec de graves problèmes de clairance autophagique en raison d’une acidification lysosomale insuffisante (Rujano et al, 2017; Cannata Serio et al, 2018). Nous caractérisons actuellement d’autres acteurs de l’assemblage de la V-ATPase ainsi que leurs mutations dans les maladies génétiques.
La drosophile en tant qu’outil en génétique humaine: La compréhension des maladies génétiques humaines a été améliorée par de nouvelles techniques, dont le séquençage de nouvelle génération, permettant le génotypage complet d’un grand nombre d’individus atteints et de leurs proches. Cependant, l’évaluation de la pathogénicité des variants génétiques reste encore très difficile, car les informations sur le génome humain manquent toujours de validations fonctionnelles importantes. Un objectif important du laboratoire est l’utilisation de la drosophile comme modèle d’étude pour l’identification rapide de nouveaux gènes impliqués dans des maladies héréditaires, en particulier dans le domaine de l’insuffisance rénale (Gerber et al, 2016; Cavallin et al, 2017; Lovric, Goncalves et al, 2017; Goncalves et al, 2018).
Signalisation lysosomale dans les cellules des tubules proximaux: Dans le rein, notre principal organe d’intérêt, il existe un certain nombre de cellules épithéliales différentes organisées dans des segments le long du néphron et nous nous intéressons particulièrement aux tubules contournés proximaux. Les cellules épithéliales des tubules proximaux ont un système endolysosomal très actif, car leur tâche principale est de réabsorber la quasi-totalité des protéines filtrées par le glomérule. Pour cela, les bordures en brosse apicale sont pourvues d’une voie d’absorption de protéines, impliquant les récepteurs à plusieurs ligands Megalin et Cubilin. Un défaut au niveau de cette voie d’absorption résulte en une protéinurie, caractéristique des tubulopathies proximales (par exemple, la cystinose et la maladie de Dent). Nos recherches récentes sur la drosophile ont permis de découvrir un nouveau mécanisme dans le contrôle de l’absorption apicale de protéines, avec de fortes implications pour les tubules contournés proximaux (Gleixner et al., 2014). Nos résultats les plus récents, obtenus avec l’aide de notre modèle, la drosophile, suggéraient que la signalisation mTOR lysosomale – une voie majeure de détection des nutriments qui contrôle les décisions métaboliques de la surface lysosomale – régule l’expression de Megalin ainsi que la morphogenèse de la surface apicale. En outre, nous avons constaté que la cystine, issue de la protéolyse lysosomale, peut inhiber la signalisation de mTOR et ainsi stimuler l’autophagie dans des conditions de famine prolongée. Nous étudions aussi comment les ligands protéiques et lipidiques de la lumière tubulaire peut activer la signalisation des récepteurs nucléaires pour satisfaire les besoins métaboliques élevés des tubules contournés proximaux.
Figure descriptive
Publications
– Guida, M. C., Hermle, T., Graham, L. A., Hauser, V., Ryan, M., Stevens, T. H., Simons, M. ATP6AP2 functions as a V-ATPase assembly factor in the endoplasmic reticulum. Mol Biol Cell, 2018 Sep 1; 29(18): 2156-2164.
– Gonçalves, S., Patat, J., Guida, M. C., et al. A homozygous KAT2B variant modulates the clinical phenotype of ADD3 deficiency in humans and flies. PLoS Genet, 2018 May 16; 14(5): e1007386.
– Rujano, M. A., Cannata Serio, M., Panasyuk, G., et al. Mutations in the X-linked ATP6AP2 cause a glycosylation disorder with autophagic defects. J Exp Med, 2017 Dec 4; 214(12): 3707-3729.
– Lovric, S., Goncalves, S., Gee, H. Y., et al. Mutations in sphingosine-1-phosphate lyase cause nephrosis with ichthyosis and adrenal insufficiency. J Clin Invest, 2017 Mar 1; 127(3): 912-928.
– Trepiccione, F., Gerber, S. D., Grahammer, F. et al. Renal Atp6ap2/(Pro)renin Receptor Is Required for Normal Vacuolar H+-ATPase Function but Not for the Renin-Angiotensin System. J Am Soc Nephrol. 2016 Nov; 27(11): 3320-3330.
– Gleixner, E. M., Canaud, G., Hermle, T., Guida, M. C., Kretz, O., Helmstädter, M., Huber, T. B., Eimer, S., Terzi, F., Simons, M. V-ATPase/mTOR signaling regulates megalin-mediated apical endocytosis. Cell Rep, 2014 Jul 10; 8(1): 10-9.
Composition de l'équipe
Matias SIMONS, chef d’équipe (matias.simons(at)institutimagine.org)
Valentina MARCHESIN, postdoc (valentina.marchesin(at)institutimagine.org)
Zvonimir MARELJA, postdoc (zvonimir.marelja(at)institutimagine.org)
Albert PEREZ MARTI, postdoc (albert.perez-marti(at)institutimagine.org)
Gwenn LE MEUR, ingénieur d’étude (gwenn.le-meur(at)institutimagine.org)
Magda CANNATA SERIO, doctorante (magda.cannata-serio(at)institutimagine.org)
Mathilda BEDIN, doctorante (mathilda.bedin(at)institutimagine.org)
Chiara Garsia, M2 étudiante (chiara.garsia(at)gmail.com)