Autophagie et Cancer
Institute of PathologyUniversity of Bern
Murtenstrasse 31
CH-3008 Bern, Switzerland - Bern
Site web - mario.tschan@pathology.unibe.ch - 41316328780
Responsable d'équipe
Mario P. Tschan

Thématiques de recherche
Les membres de mon équipe de recherche partagent la volonté d’identifier la fonction de l’autophagie ainsi que sa régulation dans différents cancers : les leucémies aiguës myéloïdes (LAM), les cancers du sein, de l’œsophage et du poumon. Avec la collaboration de pathologistes, nous déchiffrons les mécanismes moléculaires aberrants de la voie de signalisation de la réponse autophagique dans ces tumeurs. De plus, nous examinons le rôle de l’autophagie dans les mécanismes de résistances aux chimiothérapies et thérapies ciblées.
– Analyse moléculaire de la voie de signalisation de l’autophagie dans les thérapies basées sur l’induction de la différentiation des leucémies aigües myéloïdes (LAM)
Les rétinoïdes sont des dérivés naturels de la vitamine A, qui exercent leurs fonctions via l’activation de l’expression des gènes induite par le récepteur de l’acide rétinoïque nucléaire.
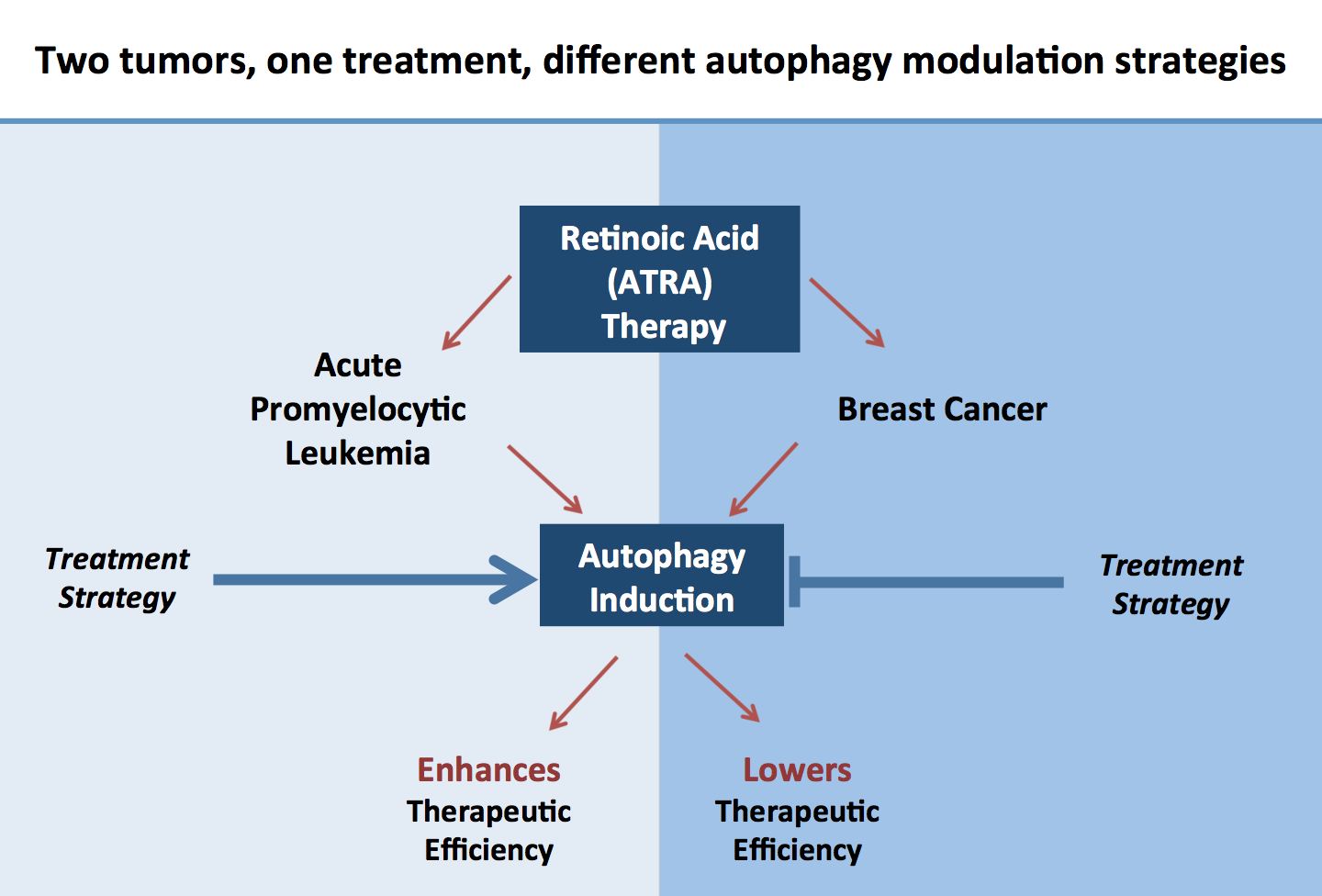
L’acide tout transrétinoïque (ATRA) est utilisé avec succès dans le traitement de la leucémie aiguë promyélocytaire (LAP) en induisant la différentiation granulocytaire des cellules leucémiques. Notre équipe et d’autres groupes, avons démontré une augmentation significative de l’activité macroautophagique pendant le traitement par ATRA ainsi qu’un blocage de la différentiation granulocytaire des cellules LAP lorsque l’autophagie est inhibée génétiquement ou pharmacologiquement.
En conséquence, nous avons observé une réduction significative de l’expression de gènes clé dans le processus de l’autophagie dans les cellules primaires de patients LAM en comparaison avec des granulocytes de sujets sains. De plus, le traitement par ATRA en combinaison avec des inducteurs de l’autophagie accélère de manière significative la différenciation des cellules LAP. Dans l’ensemble, nos données fournissent des preuves tangibles qu’un type particulier d’autophagie, non-canonique et indépendant de Beclin-1 et d’ATG16L1, est activé pendant la différentiation granulocytaire des cellules LAP.
Un autre intérêt de mon laboratoire est de comprendre comment la protéine Death Associated Protein Kinase 2 (DAPK2) contribue à l’autophagie induite par les thérapies de LAP. Nos récentes découvertes démontrent que deux différentes voies de signalisations sont opératives pendant le traitement avec ATRA ou le trioxyde d’arsénique (ATO). DAPK2 est essentiel pour l’autophagie induite par ATRA mais pas pour celle induite par ATO. Néanmoins DAPK2 est indispensable pour la mort cellulaire induite par ATO.
Pour finir, dans un projet dirigé par Magali Humbert, nous étudions l’implication de l’autophagie médiée par les protéines chaperonnes (CMA) et sa réciprocité avec la macroautophagie non-canonique pendant les thérapies de LAP induisant la différenciation. Ce projet inclut également une étude sur la niche des cellules leucémiques et son influence sur l’activité autophagique des cellules LAM.
– La thérapie par l’acide rétinoïque et l’autophagie dans le cancer du sein
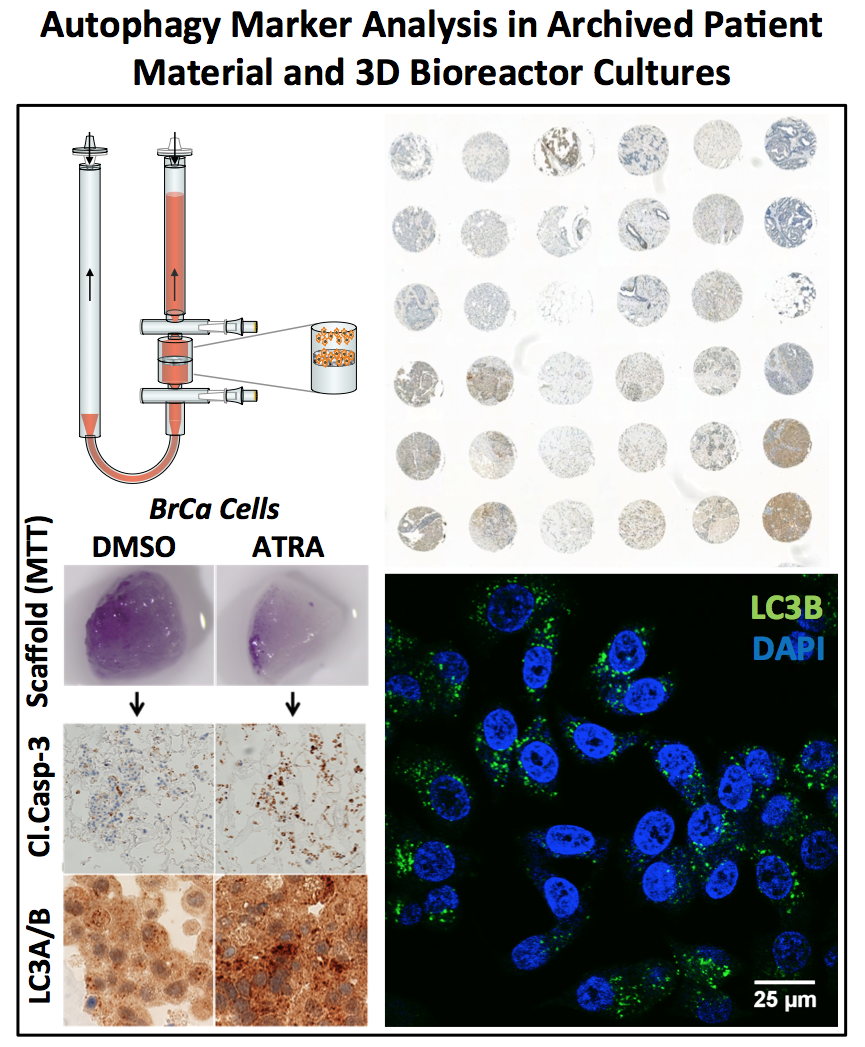
Les études cliniques utilisant ATRA pour traiter le cancer du sein furent plutôt décevantes, c’est pourquoi une meilleure compréhension de la toxicité et de la différentiation induites par ATRA dans les cellules du cancer du sein est nécessaire. Nous avons découvert que ATRA augmente de manière significative l’activité autophagique dans les cellules du cancer du sein exprimant le récepteur de l’acide rétinoïque alpha. En bloquant l’autophagie en combinaison avec le traitement par ATRA, les cellules du cancer du sein meurent significativement plus par apoptose. De plus, l’autophagie peut soutenir l’acquisition des traits épithéliaux des cellules saines et cancéreuses. Nos recherches actuelles dirigées par Anna Schläfli ont pour but d’analyser la fonction de l’autophagie dans la différentiation épithéliale des cellules du cancer du sein afin d’améliorer la thérapie par les rétinoïdes.
Figure descriptive
Publications
1. Jin J, Britschgi A, Schläfli AM, Humbert M, Shan-Krauer D, Batliner J, Federzoni EA, Ernst M, Torbett BE, Yousefi S, Simon HU, Tschan MP. Low Autophagy (ATG) Gene Expression Is Associated with an Immature AML Blast Cell Phenotype and Can Be Restored during AML Differentiation Therapy. Oxid Med Cell Longev, Volume 2018, Article ID 1482795.
2. Schläfli AM, Isakson P, Garattini E, Simonsen A, Tschan MP.The autophagy scaffold protein ALFY is critical for the granulocytic differentiation of AML cells. Sci Rep. 2017 Oct 11;7(1):12980.
3. Humbert M, Federzoni EA, Tschan MP. Distinct TP73-DAPK2-ATG5 pathway involvement in ATO-mediated cell death versus ATRA-mediated autophagy responses in APL. J Leukoc Biol. 2017 Dec;102(6):1357-1370.
4. Niklaus M, Adams O, Berezowska S, Zlobec I, Graber F, Slotta-Huspenina J, Nitsche U, Rosenberg R, Tschan MP, Langer R. Expression analysis of LC3B and p62 indicates intact activated autophagy is associated with an unfavorable prognosis in colon cancer. Oncotarget. 2017 May 2;8(33):54604-54615.
5. Rothschild SI, Gautschi O, Batliner J, Gugger M, Fey MF, Tschan MP. MicroRNA-106a targets autophagy and enhances sensitivity of lung cancer cells to Src inhibitors. Lung Cancer. 2017 May;107:73-83.
6. Berezowska S, Galván JA. Immunohistochemical Detection of the Autophagy Markers LC3 and p62/SQSTM1 in Formalin-Fixed and Paraffin-Embedded Tissue.
Methods Mol Biol. 2017;1560:189-194.
7. Adams O, Dislich B, Berezowska S, Schläfli AM, Seiler CA, Kröll D, Tschan MP, Langer R. Prognostic relevance of autophagy markers LC3B and p62 in esophageal adenocarcinomas. Oncotarget. 2016 Jun 28;7(26):39241-39255.
8. Schläfli AM, Adams O, Galván JA, Gugger M, Savic S, Bubendorf L, Schmid RA, Becker KF, Tschan MP, Langer R, Berezowska S. Prognostic value of the autophagy markers LC3 and p62/SQSTM1 in early-stage non-small cell lung cancer. Oncotarget. 2016 Jun 28;7(26):39544-39555.
9. Schläfli AM, Berezowska S, Adams O, Langer R, Tschan MP. Reliable LC3 and p62 autophagy marker detection in formalin fixed paraffin embedded human tissue by immunohistochemistry. Eur J Histochem. 2015 May 5;59(2):2481.
10. Brigger D, Schläfli AM, Garattini E, Tschan MP. Activation of RARα induces autophagy in SKBR3 breast cancer cells and depletion of key autophagy genes enhances ATRA toxicity. Cell Death Dis. 2015 Aug 27;6:e1861.
Composition de l'équipe
Magali Humbert, postdoc, magali.humbert@pathology.unibe.ch
Félice Janser, PhD student, ariane.janser@pathology.unibe.ch
Deborah Krauer, laboratory technician, deborah.shan@pathology.unibe.ch
Sophie Milesi, Master student, sophie.milesi@pathology.unibe.ch
Severin Mosimann, Master student, severin.mosimann@pathology.unibe.ch
Nicolas Niklaus, PhD student, nicolas.niklaus@pathology.unibe.ch
Sarah Parejo, Laboratory technician, sarah.parejo@pathology.unibe.ch
Sreoshee Rafiq, PhD student, sreoshee.rafiq@pathology.unibe.ch
Kristina Seiler, MD-PhD student, kristina.seiler@pathology.unibe.ch
Anna Schläfli Bill, postdoc, anna.schlaefli@pathology.unibe.ch
Igor Tokarchuk, MD-PhD student, igor.tokarchuk@pathology.unibe.ch
Mario P. Tschan, Associate Professor, mario.tschan@pathology.unibe.ch
Collaborations avec des cliniciens
Rupert Langer, MD, Associate Professor, rupert.langer@pathology.unibe.ch
Sabina Berezowska, MD. Assistant Professor, sabina.berezowska@pathology.unibe.ch