Gènes-Nutriments (GN)
Gènes-Nutriments (GN)Université Clermont-Auvergne
Clermont-Ferrand - Clermont-Ferrand
Site web - pierre.fafournoux@inra.fr -
Responsable d'équipe
Pierre Fafournoux

Thématiques de recherche
Les projets développés par l’équipe « Gènes-Nutriments » sont partis de deux observations : 1- Les mammifères ne sont pas capables de synthétiser les acides aminés (AA) indispensables. Par conséquent, en cas de déficit, une adaptation des fonctions cellulaires et physiologiques est obligatoire. 2- Certaines situations nutritionnelles simples suggèrent que les AAs pourraient jouer un rôle de « molécules signal » dans ces processus d’adaptation. Ces observations nous ont conduit à nous poser la question suivante: Les acides aminés peuvent-ils, au travers de la régulation de l’expression des gènes, réguler des fonctions physiologiques ?
A la création de l’équipe, les mécanismes par lesquels une limitation en AA conduisait à la surexpression d’un gène n’étaient pas connus. Notre équipe a contribué à l’identification d’une voie de signalisation régulée par un manque d’acide aminé: la voie GCN2/eIF2/ATF4.
Ces dernières années les principaux axes de travail de l’équipe sont les suivants:
– Identifier les mécanismes impliqués dans la régulation de l’expression des gènes et des voies de signalisation par un manque en AA. En particulier, nous avons montré des interactions entres les voies régulées par les kinases GCN2 et mTORC1 (Articles 2,6).
– Identifier les fonctions cellulaires et physiologiques régulées par la voie GCN2/eIF2a/ATF4 (autophagie et prise alimentaire) (Articles 5,7,8).
– Identifier le rôle de la signalisation eIF2a/ATF4 dans des cellules tumorales carencées en AA (Article 1).
– Optimiser un système d’expression génique inductible par une manipulation nutritionnelle et utilisable en thérapie génique (Articles 3,4).
– Etudier les conséquences d’une malnutrition protéique pendant la période périnatale de la vie (Article 9).
Nos recherches dans le domaine de la nutrition nous ont conduits vers l’autophagie. En effet, en cas de carence alimentaire en AA une stimulation de la protéolyse vient compenser le manque d’AA et permettre le maintien de la synthèse protéique dans les organes les plus sensibles. La littérature décrit un rôle prépondérant de l’inhibition de la protéine kinase mTORC1 dans le déclenchement de l’autophagie. Cependant, la voie de signalisation passant par GCN2 étant également contrôlée par la disponibilité en AA, nous avons fait l’hypothèse qu’elle pourrait réguler l’autophagie.
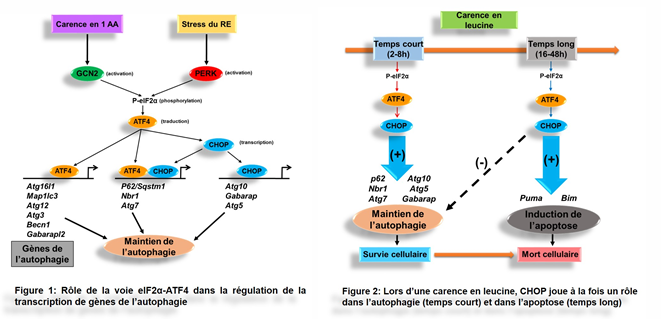
Dans un premier temps, nous avons mis en évidence que la voie de signalisation eIF2α/ATF4 régule l’expression de groupes de gènes impliqués dans le processus autophagique (Article 8). Nous avons identifié trois classes de gènes de l’autophagie selon leur dépendance aux facteurs de transcription ATF4 et CHOP et la liaison de ces facteurs sur les éléments spécifiques de leurs promoteurs (Figure 1).
Nous avons également montré que durant les six premières heures de la carence en acides aminés, la voie eIF2α/ATF4/CHOP favorise la survie cellulaire en maintenant l’autophagie (Article 5). Cependant, lorsque la carence en acides aminés est prolongée (16-48h), CHOP joue un rôle clé dans la régulation de l’apoptose et dans la répression du processus autophagique en contrôlant la transcription des gènes cibles spécifiques (Figure 2).
Par ailleurs, nous avons observé que la carence en leucine se traduisait par une activation rapide du processus autophagique (<1h) de manière dépendante de GCN2. Nous cherchons donc à déterminer le rôle de GCN2 dans la régulation des évènements précoces d’activation de l’autophagie.
Figure descriptive
Publications
1- Mesclon F, Lambert-Langlais S, Carraro V, Parry L, Hainault I, Jousse C, Maurin AC, Bruhat A, Fafournoux P, Averous J. Decreased ATF4 expression as a mechaanism of acquired resistance to long-term amino acid limitation in cancer cells Oncotarget. 2017 in press.
2- Averous J, Lambert-Langlais S, Mesclon F, Carraro V, Parry L, Jousse C, Bruhat A, Maurin AC, Pierre P, Proud CG, Fafournoux P. GCN2 contributes to mTORC1 inhibition by leucine deprivation through an ATF4 independent mechanism. Sci Rep. 2016 Jun 14;6:27698.
3- Chaveroux C, Bruhat A, Carraro V, Jousse C, Averous J, Maurin AC, Parry L, Mesclon F, Muranishi Y, Cordelier P, Meulle A, Baril P, Do Thi A, Ravassard P, Mallet J, Fafournoux P. Regulating the expression of therapeutic transgenes by controlled intake of dietary essential amino acids. Nat Biotechnol. 2016 Jul;34(7):746-51.
4- Chaveroux C, Carraro V, Canaple L, Averous J, Maurin AC, Jousse C, Muranishi Y, Parry L, Mesclon F, Gatti E, Mallet J, Ravassard P, Pierre P, Fafournoux P, Bruhat A. In vivo imaging of the spatiotemporal activity of the eIF2α-ATF4 signaling pathway : insight into stress and related disorders. Sci Signal. 2015 Apr 28;8(374):rs5.
5- B’chir W, Chaveroux C, Carraro V, Averous J, Maurin AC, Jousse C, Muranishi Y, Parry L, Fafournoux P, Bruhat A. Dual role for CHOP in the crosstalk between autophagy and apoptosis to determine cell fate in response to amino acid deprivation. Cell Signal. 2014 Jul;26(7):1385-91.
6- Averous J, Lambert-Langlais S, Carraro V, Gourbeyre O, Parry L, B’Chir W, Muranishi Y, Jousse C, Bruhat A, Maurin AC, Proud CG, Fafournoux P. Requirement for lysosomal localization of mTOR for its activation differs between leucine and other amino acids. Cell Signal. 2014 Sep;26(9):1918-27.
7- Maurin AC, Benani A, Lorsignol A, Brenachot X, Parry L, Carraro V, Guissard C, Averous J, Jousse C, Bruhat A, Chaveroux C, B’chir W, Muranishi Y, Ron D, Pénicaud L, Fafournoux P. Hypothalamic eIF2α signaling regulates food intake. Cell Rep. 2014 Feb 13;6(3):438-44.
8- B’chir W, Maurin AC, Carraro V, Averous J, Jousse C, Muranishi Y, Parry L, Stepien G, Fafournoux P, Bruhat A. The eIF2α/ATF4 pathway is essential for stress-induced autophagy gene expression. Nucleic Acids Res. 2013 Sep;41(16):7683-99.
9- Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A, Carraro V, Tost J, Letteron P, Chen P, Jockers R, Launay JM, Mallet J, Fafournoux P. Perinatal undernutrition affects the methylation and expression of the leptin gene in adults: implication for the understanding of metabolic syndrome. FASEB J. 2011 Sep;25(9):3271-8.