Angiogenèse normale et pathologique
- NiceSite web - gilles.pages@uni-cotedazur.fr - 0492031231
Responsable d'équipe
Dr Gilles Pagès

Thématiques de recherche
Définir les mécanismes de résistance pour prévenir les récidives et développer de nouveaux agents thérapeutiques dans les cancers du rein métastatiques.
L’un des enjeux de l’équipe porte sur l’étude des mécanismes de résistance aux thérapies anti-angiogéniques des carcinomes rénaux à cellules claires métastatiques. Les mécanismes de résistance au sunitinib, un anti-angiogénique donné en première ligne de traitement chez les patients atteints d’un cancer du rein métastatique constituent notre objectif majeur.
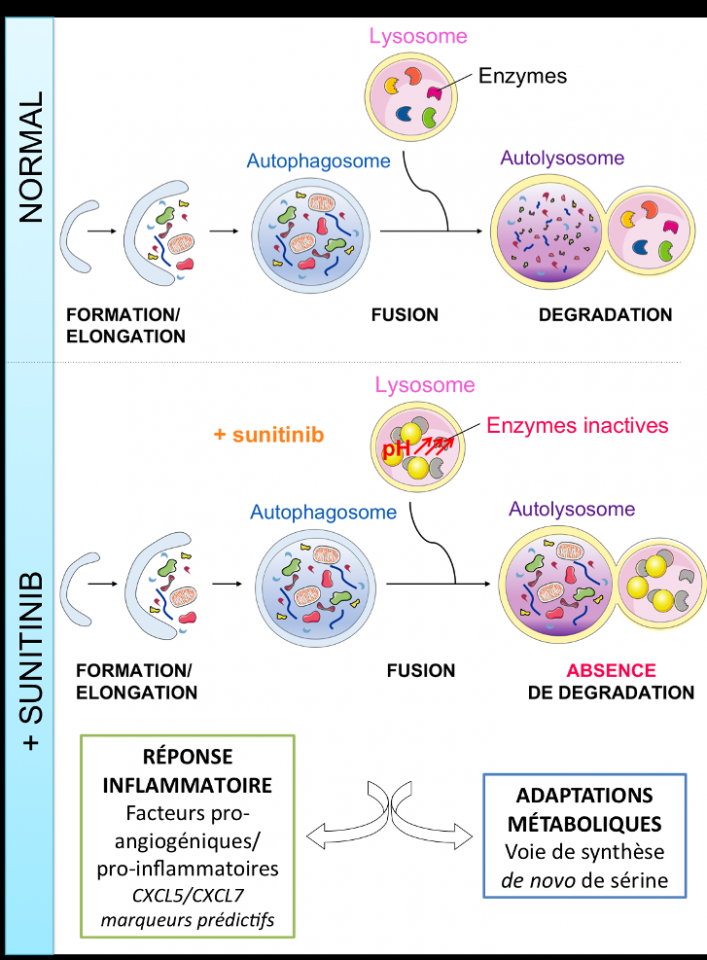
Parmi les nombreux mécanismes développés par la tumeur pour échapper aux traitements, leur distribution subcellulaire est un paramètre essentiel à prendre en considération. Pour un effet thérapeutique optimal, la localisation intracellulaire de la cible doit correspondre à celle de la drogue. Ses propriétés physico-chimiques telles que le pKa et le logP influencent la pharmacodynamique et la pharmacocinétique des médicaments. Les drogues lipophiles (logP>1) avec des amines ionisables (pKa>6) s’accumulent dans les lysosomes de manière passive (diffusion) et/ou active (pompe à efflux de type ABC) où elles seront protonées et piégées. Cette séquestration lysosomale les empêche d’atteindre leurs cibles.
Le sunitinib, identifié comme lysosomotrope, conduit à une inhibition du processus autophagique, une réponse inflammatoire et une adaptation métabolique.
Nos travaux ont montré que : i) le sunitinib, initialement développé contre des cibles intracytoplasmiques, présente des propriétés lysosomotropes, conduisant à son accumulation au sein des lysosomes ii) sa séquestration diminue l’activité des hydrolases lysosomales entrainant l’inhibition du processus autophagique iii) cette inhibition participe à la résistance des cellules tumorales ; la chloroquine limite la séquestration du sunitinib et augmente son activité.
Ces résultats publiés dans Autophagy (1) nous ont permis de déposer un brevet européen (INSERM WO2016184793 A1).
Une des premières conséquences de l’inhibition du processus autophagique est une réponse inflammatoire caractérisée par une induction massive de deux facteurs, CXCL5 et CXCL7. Les patients présentant dans leur plasma une concentration élevée de CXCL5 ou CXCL7 présentent une meilleure survie sans progression. Ainsi, CXCL5 et CXCL7 sont des nouveaux marqueurs prédictifs de la réponse au sunitinib. Ces résultats ont été publiés dans Br J Cancer (2) et dans Theranostics (3).
Enfin, nos résultats transcriptomiques, protéomiques et métabolomiques nous ont permis d’identifier la voie de synthèse de novo de sérine comme un mécanisme de résistance au traitement sunitinib. Notre hypothèse de travail stipule que les cellules tumorales sous sunitinib s’adaptent en reprogrammant leurs voies métaboliques et induisent des mécanismes de compensations/substitutions au manque du processus autophagique.
Autophagie et stratégie antitumorale
Ce travail majoritairement consacré au sunitinib, qui est le traitement de première ligne des carcinomes rénaux à cellules claires métastatiques, sera étendu aux autres inhibiteurs de kinases “multi-cibles” administrés en seconde ou troisième ligne thérapeutique (axitinib, pazopanib et cabozantinib) mais également aux autres lysosomotropes ainsi qu’à d’autres cancers, notamment les cancers du sein pour lesquels nous avons démontré la pertinence de la séquestration lysosomale du lapatinib, un inhibiteur des récepteurs de l’EGF, conduisant également à l’expression de CXCL5.
Ainsi, approfondir la fonction de l’autophagie dans les mécanismes de résistance au travers de traitements lysosomotropes nous permettrait de mieux appréhender l’intérêt thérapeutique d’activer ou d’inhiber l’activation ou l’inhibition du processus autophagique.
Figure descriptive
Publications
(1) Sandy Giuliano, Yann Cormerais, Maeva Dufies, Renaud Grépin, Pascal Colosetti, Amine Belaid, Julien Parola, Anthony Martin, Sandra Lacas-Gervais, Nathalie Mazure, Rachid Benhida, Patrick Auberger, Baharia Mograbi, Gilles Pagès.
Resistance to sunitinib in renal clear cell carcinoma results from sequestration in lysosomes and inhibition of the autophagic flux.
Autophagy. 2015 Oct 3;11(10):1891-904.
(2) Sandy Giuliano, Maeva Dufies, Papa Diogop Ndiaye, Julien Viotti, Delphine Borchiellini, Julien Parola, Valérie Vial, Yann Cormerais, Mickaël Ohanna, Véronique Imbert, Emmanuel Chamorey, Nathalie Rioux-Leclercq, Ariel Savina, Jean-Marc Ferrero, Baharia Mograbi, Gilles Pagès
Resistance to lysosomotropic drugs used to treat kidney and breast cancers involves autophagy and inflammation and converges in inducing CXCL5.
Theranostics. 2019 Jan 30;9(4):1181-1199.
(3) Maeva Dufies*, Sandy Giuliano*, Julien Viotti, Delphine Borchiellini, Linsay S Cooley, Damien Ambrosetti, Mélanie Guyot, Papa Diogop Ndiaye, Julien Parola, Audrey Claren, Renaud Schiappa, Jocelyn Gal, Antoine Frangeul, Arnaud Jacquel, Ophélie Cassuto, Renaud Grépin, Patrick Auberger, Andréas Bikfalvi, Gérard Milano, Bernard Escudier, Nathalie Rioux-Leclercq, Camillo Porta, Sylvie Negrier, Emmanuel Chamorey, Jean-Marc Ferrero, and Gilles Pagès, (* These authors have contributed equally)
CXCL7 is a predictive marker of sunitinib efficacy in clear cell renal cell carcinomas.
Br J Cancer. 2017 Sep 26;117(7):947-953.
Composition de l'équipe
Dr Gilles Pagès (DR1 INSERM)
Roser Busca (CR1 CNRS)
Manon Campillo (Doctorante)
Anaïs Hagege (Doctorante)
Sandy Giuliano (CRCN)
Philippe Lenormand (CR1 INSERM)
Frédéric Luciano (CR1 INSERM)
Sonia Martial (CR1 CNRS)
Cercina Onesto (MCU)
Julien Parola (Lab Manager / technicien)
Jacques Pouyssegur (Eméritat CNRS)
Olivia Rastoin (Assistante ingénieur)
Manon Teisseire (Master 2)