Microbiologie cellulaire et physique de l’infection
Center of Infection and Immunity of LilleCNRS UMR 8204 – INSERM U1019
Institut Pasteur de Lille – CHRU de Lille – Université de Lille
1, rue du Professeur Calmette, F-59019 Lille Cedex
- Lille
Site web - frank.lafont@pasteur-lille.fr -
Responsable d'équipe
Frank Lafont

Thématiques de recherche
D’après les chiffres donnés par l’OMS, les maladies infectieuses représentent la seconde cause majeure de mortalité. L’effort de Recherche sur les agents infectieux est sous-tendu par les pathogènes émergents et par les menaces d’épidémies et de pandémies responsables de taux de morbidité et mortalité élevés. Egalement, la possibilité d’utilisation des micro-organismes pathogènes comme agents du bio-terrorisme renforce le développement de nouvelles stratégies thérapeutiques efficaces.
Nous nous intéressons aux étapes précoces de l’infection aux niveaux moléculaires et cellulaires. Nos Recherches sont centrées sur les mécanismes cellulaires détournés par les pathogènes pour adhérer et envahir les cellules hôtes. Les pathogènes ont développé de nombreuses stratégies pour usurper les machineries moléculaires de l’hôte afin d’échapper à la réponse immunitaire et pour assurer une infection efficace.
Nous développons une approche interdisciplinaire combinant génétique bactérienne, biologie cellulaire et moléculaire, biochimie et biophysique pour étudier comment les pathogènes interagissent avec la surface cellulaire de l’hôte, comment la cellule répond à cette attaque et comment les pathogènes détournent cette réponse. Le but est d’identifier de nouvelles cibles moléculaires pour développer de nouveaux outils thérapeutiques qui serviront à inhiber l’infection.
Les thématiques principales sont :
-Le rôle de l’autophagie dans les mécanismes infectieux liés à l’invasion cellulaire des pathogènes bactériens. Nous étudions les mécanismes de contrôle de la vacuole bactérienne impliquant les mécanismes liés à sa rupture et au trafic membranaire permettant sa régulation. Nous avons montré l’importance de l’autophagie dans la réponse cellulaire (y.c. la survie/mort de la cellule infectée) au dommage membranaire causé par la rupture vacuolaire de Shigella avec l’implication des galectines, des adaptateurs et de l’ubiquitination (Dupont et al. CHM 2009, Paz et al. Cellular Microbiol 2010). Nous avons aussi montré comment Yersinia pseudotuberculosis peut usurper l’autophagie pour se répliquer dans les cellules infectées (Moreau et al. Cellular Microbiol 2010, Ligeon et al. Autophagy 2014). Nous développons des méthodes de suivi en microscopie de super-résolution et corrélative (Ligeon et al. Methods 2015) et de nouvelles approches pour discriminer entre signalisation associée à la liaison aux surfaces cellulaires et à l’internalisation des pathogènes (projet ANR-2015).
-Le rôle des propriétés biophysiques des membranes dans le contrôle de la transduction du signal au cours des interactions hôtes-pathogènes. Nous analysons comment les forces d’interactions et d’adhésion, l’élasticité membranaire ou cellulaire, la viscosité participent à la régulation de la signalisation déclenchée par l’interaction d’un pathogène ou d’une toxine aux membranes cellulaires (Mostowy et al Biophy J 2011 ; Maddugoda et al. CHM 2011 ; Gonzalez-Rodriguez et al. PRL 2012, Bernard et al. Nat Med 2014). Nous développons nos approches sur des modèles au-delà de la thématique infectieuse car ces aspects de biomécanique cellulaire ont des implications sur de nombreux champ disciplinaire (projet ANR-2015).
Figure descriptive
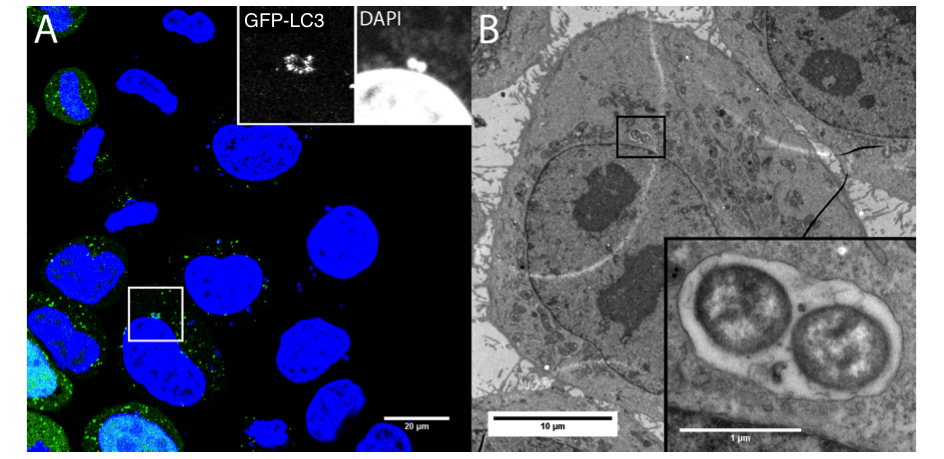
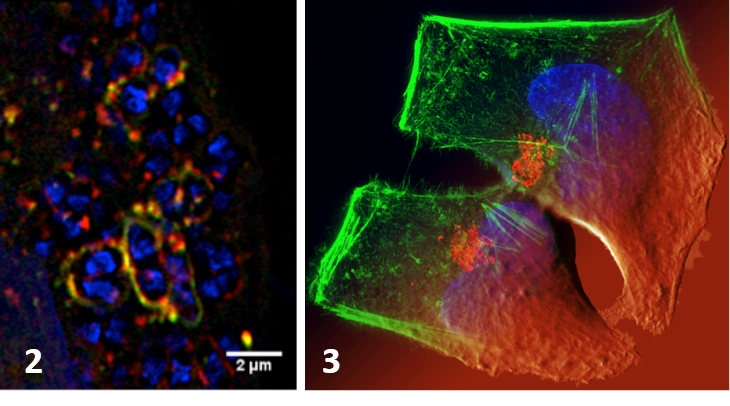
Publications
– Dupont N, Lacas-Gervais S, Bertout J, Paz I, Freche B, Van Nhieu GT, van der Goot FG, Sansonetti PJ, Lafont F. Shigella phagocytic vacuolar membrane remnants participate in the cellular response to pathogen invasion and are regulated by autophagy. (2009) Cell Host Microbe. 6:137-49.
-Dupont N, Lafont F. How autophagy regulates the host cell signaling associated with the postpartum bacteria cocoon experienced as a danger signal. (2009) Autophagy. Nov;5(8):1222-3.
-Lafont F. Autophagy employs a new DAGger against bacteria. (2010) Cell Host & Microbe 8:129-130.
-Dupont N, Temime-Smaali N, Lafont F. How ubiquitination and autophagy participate in the regulation of the cell response to bacterial infection (2010) Biology of the Cell 102:621-634
-Paz I, Sachse M, Dupont N, Cederfur C, Enninga J, Leffler H, Poirier F, Prevost MC, Lafont F, Sansonetti P. Galectin-3, a marker for vacuole lysis by invasive pathogens. (2010) Cell Microbiol. 12 :530-544
-Moreau K, Lacas-Gervais S, Fujita N, Sebbane F, Yoshimori T, Simonet M, Lafont F. Autophagosomes can support Yersinia pseudotuberculosis replication in macrophages. (2010) Cell Microbiol. 12 :1108-1123.
-Mostowy S, Janel S, Forestier C, Roduit C, Kasas S, Pizarro-Cerda J, Cossart P, Lafont F A Role for Septins in the Interaction between the Listeria monocytogenes Invasion Protein InlB and the Met Receptor. (2011) Biophys. J. 100 :1949-1959
-Maddugoda MP, Stefani C, Gonzalez-Rodriguez D, Saarikangas J, Torrino S, Janel S, Munro P, Doye A, Prodon F, Aurrand-Lions M, Goossens PL, Lafont F, Bassereau P, Lappalainen P, Brochard F, Lemichez E. Anthrax co‐opts cAMP signaling to induce transendothelial cell tunnels, a Dewetting phenomenon counteracted by MIM (2011) Cell Host & Microbe. 10 : 464-474
-Nacer A, Roux E, Pomel S, Scheidig-Benatar C, Sakamoto H, Lafont F, Scherf A, Mattei D. Surface Exposure of Non-functional PfEMP1 in Plasmodium falciparum with Chromosome 9 Deletion is Not Linked to clag9 Expression (2011) PLoS ONE 6(12) :e29039
-Ligeon LA, Temime-Smaali N, Lafont F.Ubiquitylation and autophagy in the control of bacterial infections and related inflammatory responses (2011) Cellular Microbiol. 13:1303-1311.
-Klionsky D.J., (…) Lafont F et al. Guidelines for the use and interpretation of assays for monitoring autophagy (2012) Autophagy 8: 445-554.
-Gonzalez-Rodriguez D, Maddugoda MP, Stefani C, Janel S, Lafont F, Cuvelier D, Lemichez E, Brochard-Wyart F. Cellular Dewetting: Opening of Macroapertures in Endothelial Cells. (2012) Phys. Rev Letters , 208 :218105(5).
-Ligeon LA, Moreau K, Barois N, Bongiovanni A, Lacorre DA, Werkmeister E, Proux-Gillardeaux V, Galli T, Lafont F. Role of VAMP3 and VAMP7 in the commitment of Yersinia pseudotuberculosis to LC3-associated pathways involving single- or double-membrane vacuoles. (2014) Autophagy 10:1588-1602.
-Faure M, Lafont F. Pathogen-Induced Autophagy Signaling in Innate Immunity (2013) J Innate Immunity 5:456-470.
-Bernard SC, Simpson N, Join-Lambert O, Federici C, Laran-Chich MP, Maïssa N, Bouzinba-Ségard H, Morand PC, Chretien F, Taouji S, Chevet E, Janel S, Lafont F, Coureuil M, Segura A, Niedergang F, Marullo S, Couraud PO, Nassif X, Bourdoulous S. Pathgenic Neisserai meningitidis utilizes CD147 for vascular colonization. (2014) Nature Medicine 20:728-731
-Nollet M, Santucci-Darmanin S, Breuil V, Al-Sahlanee R, Cros C, Topi M, Momier D, Samson M, Pagnotta S, Cailleteau L, Battaglia S, Farlay D, Dacquin R, Barois N, Jurdic P, Boivin G, Heymann D, Lafont F, Lu SS, Dempster DW, Carle GF, Pierrefite-Carle V. Autophagy in Osteoblasts is involved in Mineralization and Bone Homeostasis (2014) Autophagy 10:1965-77
-Ligeon LA, Barois N, Werkmeister E, Bongiovanni A, Lafont F. Structured illumination microscopy and correlative microscopy to study autophagy (2015) Methods 75:61-68.
-Dubois-Deruy E, Belliard A, Mulder P, Bouveet M, Smet-Nocca C, Janel S, Lafont F, Beseme O, Amouyel P, Richard V, Pinet F. Interplay between troponin T phosphorylation and O-N-acetylglucosaminylation in ischaemic heart failure (2015) Cardiovasc. Res. 107:56-65
-Rodriguez-Emmenergger C., Janel S, de Los Santa Pereira A, Bruns M, Lafont F (2015) Quantifying bacterial adhesion on antifouling polymer brushes via single-cell force spectroscopy. Polymer Chem. 6, 5740-5751
Composition de l'équipe
Bauderlique Hélène, Ingénieure
Barois Nicolas, Ingénieur
Bongiovanni Antonino, Technicien
Bovio Simone, Post-doc
Ciczora Yann, Ingénieur
Dujardin Antoine, Thésard
Dupres Vincent, MCU Univ Lille 2
Janel Sébastien, Ingénieur
Popoff Michka, Thésard
Renaud Marie-Christine, Gestionnaire
Warein Joëlle, Technicienne
Werkmeister, Ingénieure