M2iSH (Microbes, Intestin, Inflammation and Susceptibilité de l’Hôte)
Inserm UMR 1071, INRAE USC 2018, Université Clermont Auvergne.Adresse : 28 Place Henri Dunant, CBRV, 63000 Clermont–Ferrand, France. - Clermont–Ferrand
Site web - hang.nguyen@uca.fr - 0473177997
Responsable d'équipe
Dr. Hang NGUYEN

Thématiques de recherche
Thématiques développées
Axe 1 : Piste infectieuse dans la maladie de Crohn (MC) et le cancer colorectal (CCR)
L’unité M2iSH, UMR 1071 Inserm/USC INRAE 2018/Université Clermont Auvergne mène depuis vingt ans des travaux consistant à analyser la relation bactéries-hôte en étudiant les Escherichia coli pathogènes impliqués dans les maladies inflammatoires chroniques de l’intestin, en particulier la maladie de Crohn (MC) et le cancer colorectal (CCR).
L’UMR 1071 a été pionnière dans la mise en évidence de la colonisation anormale de la muqueuse iléale des patients atteints de MC par des souches pathogènes d’E. coli (« adherent-invasive E. coli » ou AIEC). Notre hypothèse est que le développement de la MC pourrait être lié à une susceptibilité génétique des patients à être colonisés par des AIEC qui sont capables d’adhérer et d’envahir les cellules épithéliales intestinales, de survivre et de se multiplier dans les macrophages, et d’induire une réponse pro-inflammatoire. Depuis, le rôle des bactéries AIEC dans la MC a été confirmé par de nombreux autres laboratoires à travers le monde.
En raison du lien fort qui est maintenant clairement défini entre l’inflammation chronique et le cancer, l’unité M2iSH développe également un axe de recherche concernant l’étude d’une piste infectieuse à E. coli dans le développement du cancer colorectal. Nous avons notamment démontré que des souches d’E. coli productrices de colibactine (« colibactin-producing E. coli » ou CoPEC), une toxine induisant des cassures dans l’ADN, jouent un rôle dans la progression tumorale.
Ainsi au sein de l’UMR 1071, nous développons principalement trois axes de recherche, qui visent à : (i) explorer la virulence des E. coli impliqués dans l’étiologie des pathologies chroniques intestinales, (ii) étudier la prédisposition de l’hôte à l’infection par des E. coli dans la MC et le CCR, et (iii) développer de nouveaux biomarqueurs et des thérapies spécifiques basées sur la modulation du microbiote.
Axe 2 : Autophagie et Escherichia coli associés à la MC et au CCR (bactéries AIEC et CoPEC)
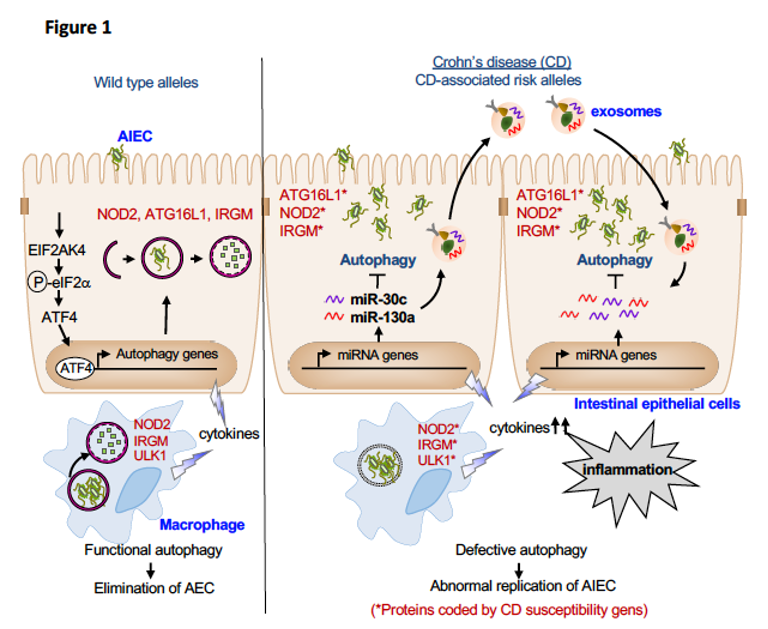
L’autophagie dysfonctionnelle est reconnue comme un facteur contributif dans de nombreuses maladies inflammatoires chroniques, y compris les maladies inflammatoires chroniques de l’intestin. Les travaux de l’UMR 1071 ont permis de mettre en évidence que l’autophagie joue un rôle central dans le contrôle des AIEC intracellulaires. Nous avons montré que les polymorphismes associés à la MC de gènes impliqués dans le processus autophagique conduisent à une autophagie défectueuse favorisant ainsi la persistance intracellulaire des AIEC et une réponse inflammatoire exacerbée.
Nous avons également montré que l’activation de la voie de réponse métabolique au stress EIF2AK4-EIF2A-ATF4 lors d’une infection par les AIEC sert de mécanisme de défense de l’hôte pour induire une autophagie fonctionnelle, indépendamment de mTOR. Ceci est nécessaire pour contrôler la réplication intracellulaire des AIEC et pour réduire l’inflammation. Étant donné que la plupart des stratégies actuelles basées sur la modulation de l’autophagie en ciblant mTOR peuvent avoir des effets indésirables, cibler la voie EIF2AK4-EIF2A-ATF4 pourrait être une stratégie prometteuse pour inhiber spécifiquement la colonisation des AIEC.
Alors que les cellules hôtes induisent une autophagie fonctionnelle pour contrôler la réplication des AIEC, ces dernières sont capables de limiter leur prise en charge par l’autophagie en augmentant le niveau de miR-30c et miR-130a, réduisant ainsi l’expression d’acteurs clés de l’autophagie ATG5 et ATG16L1. Les AIEC inhibent également l’autophagie en altérant la SUMOylation de l’hôte. Ainsi, nous avons démontré que la dérégulation de l’autophagie induite par les AIEC, via la modulation des microARN ou la SUMOylation, conduit à une réplication intracellulaire accrue des AIEC et à une inflammation exacerbée.
Récemment, nous avons montré que les exosomes, des vésicules extracellulaires de 30 à 100 nm impliquées dans la communication intercellulaire, sont de nouveaux médiateurs de l’interaction hôte-AIEC avec leur capacité à moduler la réponse immunitaire et le contrôle de la réplication des AIEC par l’autophagie. En effet, nous avons montré que lors d’une infection par les AIEC, les cellules hôtes sécrètent une quantité accrue d’exosomes, capables de transférer de cellules en cellules des microARN spécifiques, les miR-30c et miR-130a, inhibant ainsi l’autophagie dans les cellules réceptrices et par conséquence la clairance des bactéries AIEC.
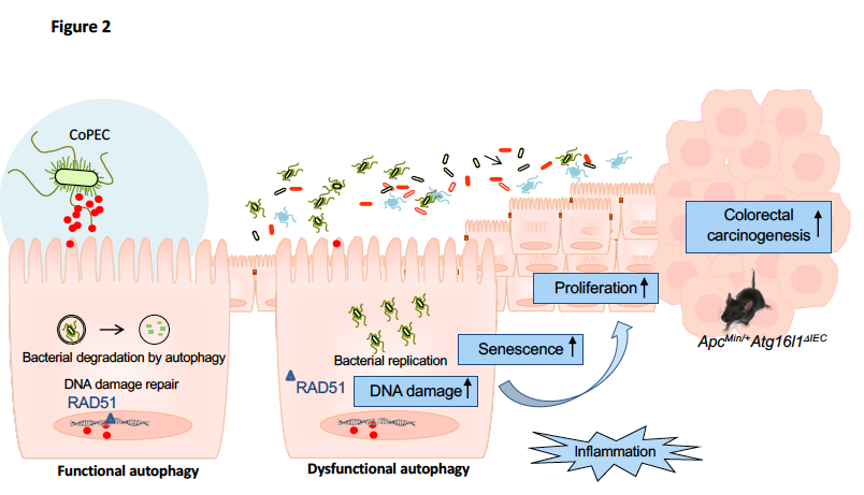
Le lien entre l’autophagie et les bactéries associées au CCR reste encore mal connu. Nous nous sommes intéressés au rôle de l’autophagie dans la défense de l’hôte suite à l’infection par les bactéries CoPEC. Nous avons montré une augmentation de l’expression des gènes de l’autophagie dans la muqueuse colique des patients atteints de CCR colonisée par des CoPEC comparativement à celle colonisée par des E. coli ne produisant pas la colibactine, suggérant que l’autophagie est activée dans les muqueuses colonisées par des CoPEC. Les résultats obtenus in vitro et in vivo ont montré que l’autophagie est activée dans les cellules hôtes suite à l’infection par les souches CoPEC. Ceci est nécessaire pour limiter les effets pro-carcinogènes et pro-inflammatoires des CoPEC, inhibant ainsi la carcinogenèse colorectale dans un modèle murin prédisposé au développement du CCR, le modèle ApcMin/+.
L’ensemble de nos études permettra de mieux comprendre le rôle de l’autophagie dans la défense de l’hôte dans la lutte contre les E. coli associés à la MC et au CCR. A plus long terme, ces travaux pourraient également contribuer au développement de nouvelles stratégies thérapeutiques basées sur la modulation de l’autophagie chez les patients présentant une colonisation anormale par les souches AIEC ou CoPEC.
Figure descriptive
Publications
1. Lucas C, Salesse L, Hoang MHT, Bonnet M, Sauvanet P, Larabi A, Godfraind C, Gagnière J, Pezet D, Rosenstiel P, Barnich N, Bonnet R, Dalmasso G, Nguyen HTT. Autophagy of intestinal epithelial cells inhibits colorectal carcinogenesis induced by colibactin-producing Escherichia coli in ApcMin/+ mice. Gastroenterology. 2020, 158(5):1373-1388. PMID: 31917256.
2. Larabi A, Dalmasso G, Delmas J, Barnich N, Nguyen HTT. Exosomes transfer miRNAs from cell-to-cell to inhibit autophagy during infection with Crohn’s disease-associated adherent-invasive E. coli. Gut Microbes. 2020, 1; 11(6):1677-1694. PMID: 32583714.
3. Buisson A, Douadi C, Ouchchane L, Goutte M, Hugot JP, Dubois A, Minet-Quinard R, Bouvier D, Bommelaer G, Vazeille E, Barnich N. Macrophages inability to mediate adherent-invasive E. coli replication is linked to autophagy in Crohn’s disease patients. Cells. 2019, 5; 8(11):1394. PMID: 31694333
4. Larabi A, Barnich N, Nguyen HTT. New insights into the interplay between autophagy, gut microbiota and inflammatory responses in IBD. Autophagy. 2019; 9:1-14. PMID: 31286804.
5. Dalmasso G Nguyen HTT, Faïs T, Massier S, Barnich N, Delmas J, Bonnet R. Crohn’s disease-associated adherent-invasive Escherichia coli manipulate host autophagy by impairing SUMOylation. Cells. 2019; 9; 8(1). PMID: 30634511.
6. Bretin A, Lucas C, Larabi A, Dalmasso G, Billard E, Barnich N, Bonnet R, Nguyen H*. AIEC infection triggers modification of gut microbiota composition in genetically predisposed mice, contributing to intestinal inflammation. Scientific Reports. 2018; 8:12301. PMID: 30120269.
7. Carrière J, Bretin A, Darfeuille-Michaud A, Barnich N, Nguyen HT. Exosomes released from cells infected with Crohn’s disease-associated adherent-invasive Escherichia coli activate host innate immune responses and enhance bacterial intracellular replication. Inflammatory Bowel Disease. 2016, 22(3):516-28. IF2014: 4.46.
8. Bretin A, Carrière J, Dalmasso G, Bergougnoux A, B’chir W, Maurin AC, Müller S, Seibold F, Barnich N, Bruhat A, Darfeuille-Michaud A, Nguyen HT. Activation of the EIF2AK4-EIF2A/eIF2α-ATF4 pathway triggers autophagy response to Crohn disease-associated adherent-invasive Escherichia coli infection. Autophagy. 2016, 12(5):770-83. PMID: 26986695.
9. Nguyen HT, Dalmasso G, Mueller S, Carriere J, Seibold F, Darfeuille-Michaud A. Crohn’s disease-associated adherent-invasive Escherichia coli affect levels of microRNAs in intestinal epithelial cells to reduce autophagy. Gastroenterology. 2014, 146(2):508-19. PMID: 24148619.
10. Nguyen HT, Lapaquette P, Bringer MA, Darfeuille-Michaud A. Autophagy and Crohn’s disease. Journal of Innate Immunity. 2013, 5(5):434-43. PMID: 23328432.
11. Lapaquette P, Bringer MA, Darfeuille-Michaud A. Defects in autophagy favour adherent-invasive Escherichia coli persistence within macrophages leading to increased pro-inflammatory response. Cellular Microbiology. 2012, 14(6):791-807. PMID: 22309232.
12. Brest P, Lapaquette P, Souidi M, Lebrigand K, Cesaro A, Vouret-Craviari V, Mari B, Barbry P, Mosnier JF, Hébuterne X, Harel-Bellan A, Mograbi B, Darfeuille-Michaud A, Hofman P. A synonymous variant in IRGM alters a binding site for miR-196 and causes deregulation of IRGM-dependent xenophagy in Crohn’s diseas. Nature Genetics. 2011, 43(3):242-5. PMID: 21278745.
13. Lapaquette P, Glasser AL, Huett A, Xavier RJ, Darfeuille-Michaud A. Crohn’s disease-associated adherent-invasive E. coli are selectively favoured by impaired autophagy to replicate intracellularly. Cellular Microbiology. 2010; 12(1):99-113. PMID: 19747213.
Composition de l'équipe
Hang NGUYEN, CR Inserm, hang.nguyen@uca.fr
Emilie VAZEILLE, Ingénieur biologiste médical, emilie.vazeille@uca.fr
Guillaume DALMASSO, MCU, guillaume.dalmasso@uca.fr
Nicolas BARNICH (responsable de l'équipe M2iSH), Professeur des universités, nicolas.barnich@uca.fr
Anthony BUISSON, MCU-PH, a_buisson@chu-clermontferrand.fr
Laurène SALESSE, étudiante en thèse, laurene.salesse@uca.fr
Clara DOUADI, étudiante en thèse, clara.duadi@uca.fr
Alison DA SILVA, étudiante en thèse, alison.da_silva@uca.fr
Hanh HOANG, postdoctorante, thi_my_hanh.hoang@uca.fr