Neuroimmunologie & thérapie peptidique
Institut de Science et d’Ingénierie Supramoléculaires (ISIS)8 Allée Gaspard Monge – BP 70028 - Strasbourg
Site web - sylviane.muller@unistra.fr - 0368855109
Responsable d'équipe
Sylviane Muller

Thématiques de recherche
La recherche poursuivie par l’équipe est centrée sur la réponse autoimmune chronique, notamment dans le lupus systémique. L’objectif de cette recherche menée chez des patients et plusieurs modèles murins autoimmuns, est de comprendre les mécanismes moléculaires et cellulaires complexes mis en jeu en amont de la perte de tolérance immunitaire et de définir des voies thérapeutiques innovantes, basées sur le développement de peptides et peptidomimétiques synthétiques, capables d’intervenir de manière ciblée dans la restauration de la tolérance au soi. Des essais cliniques avancés de phase III exploitant l’un des peptides générés et étudiés dans l’équipe (peptide P140 ; brevet CNRS) sont actuellement en cours, menés par les biotech ImmuPharma (Mulhouse/Londres) et Avion Pharmaceuticals LLC (Alpharetta, GA) chez des patients atteints de lupus systémique dont 85% sont des jeunes femmes. Au cours de tous les essais cliniques antérieurs qui ont inclus des centaines de patients autoimmuns, aucun effet secondaire notable du P140 n’a été répertorié. P140 agit comme un immunomodulateur de la réponse immunitaire, il n’a pas d’effet immunosuppresseur et lui-même n’est pas immunogène.
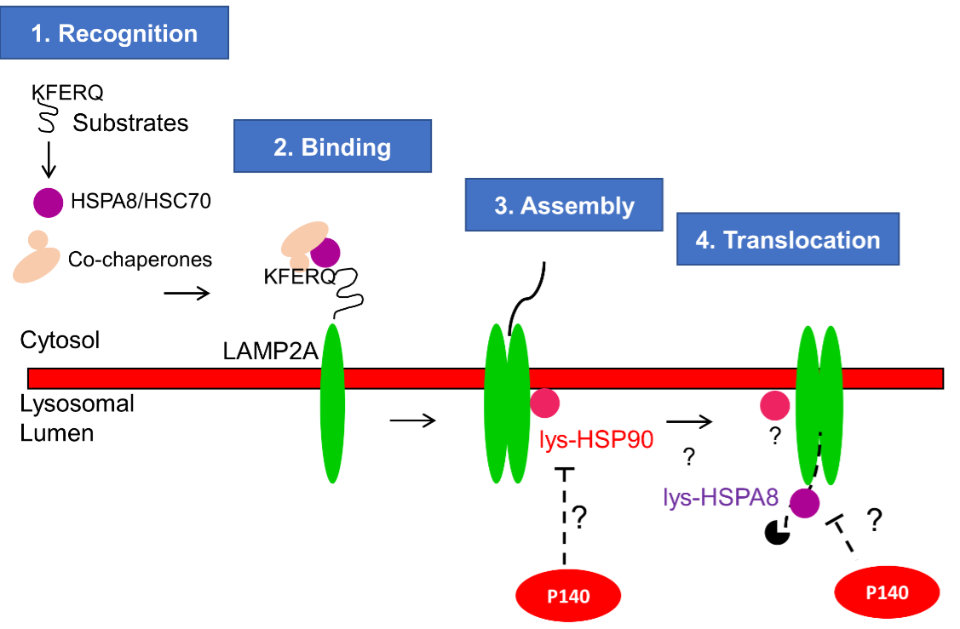
En parallèle de ces développements cliniques, nous avons poursuivi des études fondamentales dans le contexte lupique qui ont permis de décortiquer le mode d’action du peptide thérapeutique P140 qui cible et régule les mécanismes d’autophagie. Cela nous a encouragé à entamer des travaux dans d’autres maladies inflammatoires chroniques, autoimmunes (syndrome de Sjögren, polyneuropathie démyélinisante inflammatoire chronique, maladies inflammatoires chroniques de l’intestin comme le Crohn et la rectocolite hémorragique) ou non-autoimmunes (asthme, parodontite). A chaque fois, des travaux fondamentaux autour de l’autophagie sont réalisés dans l’équipe et des avancées inattendues sont obtenues (et certaines brevetées). L’importance de défauts des lysosomes apparait très souvent comme décisive dans les schémas physiopathologies découverts (d’où cette publication majeure dans Nature Rev Drug Discov en 2019). L’effet du P140 sur l’autophagie médiées par les chaperonnes (CMA) a pu être finement étudié in vitro (publié en 2015) et in vivo (publié en 2020) grâce notamment à une collaboration étroite avec Ana Maria Cuervo (Bronx, NY). De manière peu prévisible, notre équipe a récemment découvert l’existence dans le sérum de patients et souris lupiques d’une nouvelle classe d’autoanticorps qui ciblent la protéine lysosomale LAMP2A et accélèrent la maladie lupique chez des souris génétiquement prédisposées (publié en 2021). Nous considérons la voie autophagique comme une cible centrale d’immunointervention, notamment dans les situations de maladies chroniques inflammatoires.
Figure descriptive
Publications
-Page N., Gros F., Schall N., Décossas M., Bagnard D., Briand J.-P. & Muller, S. (2011) HSC70 blockade by the therapeutic peptide P140 affects autophagic processes and endogenous MHCII presentation in murine lupus. Ann. Rheum. Dis. 70, 837-843
-Gros, F., Arnold, J., Page, N., Décossas, M., Korganow, A.-S., Martin, T. & Muller, S. (2012) Macroautophagy is deregulated in murine and human lupus T lymphocytes. Autophagy 8, 1113-1123
-Stricher, F., Macri, C., Ruff, M. & Muller, S. (2013) HSPA8/HSC70 chaperone protein: structure, function and chemical targeting. Autophagy 9, 1937–1954
-Jeltsch-David, H. & Muller, S. (2014) Neuropsychiatric systemic lupus erythematosus: pathogenesis and biomarkers. Nature Rev. Neurol. 10, 579–596
-Gros, F. & Muller, S. (2014) Pharmacological regulators of autophagy and their link with modulators of lupus disease. Brit. J. Pharmacol. 170, 4337-4359
-Macri, C., Wang, F., Tasset, I., Schall, N., Page, N., Briand, J.-P., Cuervo A.M. & Muller, S. (2015) Modulation of deregulated chaperone-mediated autophagy by a phosphopeptide. Autophagy 11, 472-486.
-Wang, F. & Muller, S. (2015) Manipulating autophagic processes in autoimmune diseases: a special focus on modulating chaperone-mediated autophagy, an emerging therapeutic target. Front. Immunol. 6, 252
-Bianco, A. & Muller, S (2015) Nanomaterials, autophagy and lupus disease. ChemMedChem.11, 166-174
-Muller, S. & Radic, M. (2016) Oxidation and mitochondrial origin of NET DNA in lupus. Nature Med. 22, 126-127
-Muller, S., Brun, S., René, F., De Sèze, J., Loeffler, J.-P. & Jeltsch-David, H. (2017) Autophagy in neuroinflammatory diseases. Autoimmunity Rev. 16, 856-874
-Brun, S., Schall, N., Bonam, S.R, Bigaut, K., Mensah-Nyagan, A.G., de Sèze, J. & Muller, S. (2018) An autophagy-targeting peptide to treat chronic inflammatory demyelinating polyneuropathies. J. Autoimmunity 92, 114-125
-Li, B., Wang, F., Schall, N. & Muller, S. (2018) Rescue of autophagy and lysosome defects in salivary glands of MRL/lpr mice by a therapeutic phosphopeptide. J. Autoimmunity 90, 132-145
-Bonam, S.R, Wang, F. & Muller, S. (2018) Autophagy: a new concept in autoimmunity regulation and a novel therapeutic option. J. Autoimmunity 94, 16-32
-Retnakumar, S.V. & Muller, S. (2019) Pharmacological autophagy regulators as therapeutic agents for inflammatory bowel diseases. Trends Mol. Med. 25, 516-537
-Bonam, S.R, Wang, F. & Muller, S. (2019) Lysosomes as a therapeutic target. Nature Rev. Drug Discov. 18, 923-948
-Bonam, S.R., Tschan M.P., Bayry, J. & Muller, S. (2020) Progress and challenges in the use of MAP1LC3 as a legitimate marker for measuring dynamic autophagy in vivo. Cells 9, 1321
-Bonam, S.R., Muller, S. Bayry, J. & Klionsky, D.J. (2020) Autophagy as an emerging target for COVID-19: lessons from an old friend, chloroquine. Autophagy 16, 2260-2266
-Wang, F., Tasset, I., Cuervo, A.M. & Muller, S. (2020) In vivo remodeling of altered autophagy-lysosomal pathway by a phosphopeptide in lupus. Cells 9, 2328
-Voynova, E., Lefebvre, F., Qadri, A. & Muller, S. (2020) Correction of autophagy impairment inhibits pathology in the NOD.H-2h4 mouse model of primary Sjögren’s syndrome. J. Autoimmunity 108, 102418
-Wilhelm, M., Bonam, S.R., Schall, N., Bendorius, M., Korganow, A.-A., Lumbroso C. & Muller, S. (2021) Implication of a lysosomal antigen in the pathogenesis of lupus erythematosus. J. Autoimmunity 120, 102633
-Daubeuf, F., Schall, N., Petit-Demoulière, N., Frossard, N. & Muller, S. (2021) An autophagy modulator peptide prevents lung function decrease and corrects established inflammation in murine models of airway allergy. Cells 10, 2468
Composition de l'équipe
Sylviane Muller, Directeur de recherche émérite au CNRS, Professeur à l’Institut d’Etudes Avancées de l’Université de Strasbourg (USIAS), titulaire de la Chaire d’Immunologie thérapeutique, Directeur de l’Institut du Médicament de Strasbourg (IMS)
Thomaz Vieira, Professeur University of Minas Gerais (Brésil) année sabbatique
Laura Talamini, Post-doc (Italie)
Sruthi V. Retnakumar, Doctorante (Inde)
Nicolas Schall, Assistant-ingénieur (CDD)
Cindy Verdot, Assistant-ingénieur (CDD)
Antoine Gioux, Assistant-ingénieur (CDD)
Dylan Mastrippolito, Etudiant M2 Sciences du médicament et des produits de santé, (spécialité Pharmacologie & toxicologie)
* Hélène Jeltsch-David Chargé de recherche CNRS, détachée à l’INSERM depuis 2020