Signalisation spatiale
Tumour Biology, Barts Cancer InstituteQueen Mary University of London
John Vane Science Centre
Charterhouse Square
London EC1M 6BQ - London
Site web - -
Responsable d'équipe
Dr Stéphanie Kermorgant

Thématiques de recherche
Notre recherche est focalisée sur la compréhension des mécanismes d’une molécule appelée c-Met dans le processus métastatique.
c-Met est surexprimée ou mutée dans de nombreuses tumeurs et est une cible majeure pour la thérapie cancéreuse. C’est un récepteur tyrosine kinase. Avec son ligand, le facteur de croissance des hépatocytes (HGF), ils sont des acteurs clés du processus métastatique. Ils affectent l’adhésion cellulaire, la migration, l’invasion, l’activation de métalloproteinases et l’angiogenèse. Des drogues contre c-Met ont été élaborées et certaines ont été testées chez les patients lors d’essais cliniques.
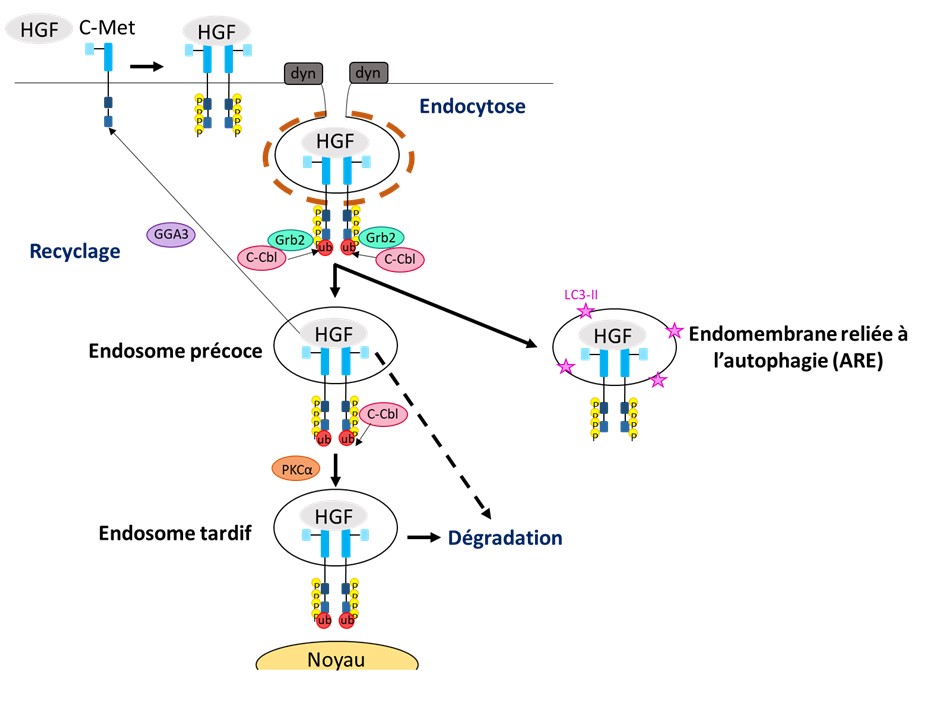
Les récepteurs comme c-Met sont normalement présents à la surface des cellules transformées dans les masses tumorales, où ils transmettent l’information (signaux) de l’extérieur à l’intérieur de la cellule afin de changer son comportement (division/ absence de division ; mouvement/ statique). Toutefois, les récepteurs peuvent entrer dans la cellule par endocytose et récemment il a été montré qu’ils peuvent transmettre des signaux depuis l’intérieur de la cellule. C’est un nouveau concept scientifique qui change notre compréhension du fonctionnement des récepteurs.
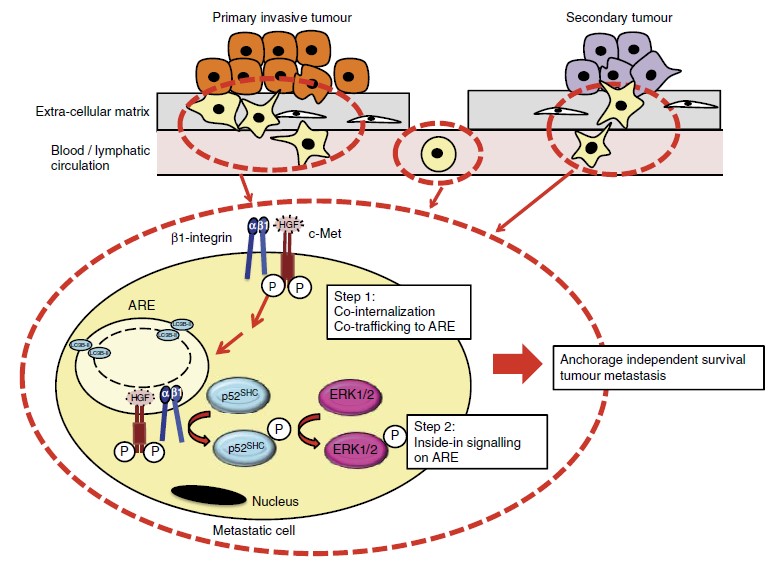
Nous étudions la signalisation de c-Met en relation avec le trafic endosomal et les effets sur la migration et l’invasion des cellules tumorales in vitro et in vivo. Nous utilisons la microscopie confocale, la biochimie, les essais de recyclage et d’internalisation, des essais fonctionnels et des modèles de tumorigenèse in vivo chez la souris. Nous investiguons la relevance clinique de nos données sur des échantillons de patient grâce à des collaborations avec des cliniciens. Nous travaillons sur les cancers du sein, des ovaires, du pancréas et du poumon. Nous avons rapporté que les mutants de c-Met trouvés chez des patients ayant un cancer sont oncogéniques non seulement parce qu’ils ont une haute activité mais aussi parce qu’ils signalent sur les endosomes. Nous avons montré que c-Met transmet via des voies de signalisation de différents endosomes incluant un nouvel endosome que nous avons récemment découvert, l’autophagie reliée aux endomembranes (ARE).
Nous prévoyons qu’une meilleure compréhension de la biologie moléculaire de c-Met intracellulaire permettra d’améliorer le traitement du cancer.
Figure descriptive
Publications
– Barrow-McGee et al, Beta 1-integrin- c-Met cooperation reveals an inside-in survival signalling on Autophagy Related Endomembranes. Nature Communications (2016) 7:11942.
– Menard et al, Receptor Tyrosine Kinase c-Met controls the cytoskeleton from different endosomes via different pathways. Nature Communications (2014) 5:3907.
– Mai et al, Distinct c-Met Activation Mechanisms Induce Cell Rounding or Invasion Through Pathways Involving Integrins, RhoA, and Hip1. J Cell Sci (2014) 127:1938-52.
– Joffre et al, A direct role for Met endocytosis in tumorigenesis. Nat Cell Biol (2011) 13(7):827-37.
Composition de l'équipe
Bakhouche Bakhouche (post-doctorant)
Waleed Badreldin (oncologue, doctorant)
Brynna Hoggard (doctorante)
Alejandro Noval (doctorant)
Marie Nollet (post-doctorante)
Georgina Wood (oncologue, doctorante)