Apoptose et Neurogénétique
Laboratoire de Biologie et de Modélisation de la Cellule, CNRS UMR5239ENS de Lyon
46 allée d’Italie 69007 Lyon
Tel: 0033- (0)472728000 - Lyon
Site web - bertrand.mollereau@ens-lyon.fr - 0472728000
Responsable d'équipe
Pr Bertrand Mollereau

Thématiques de recherche
-Rôles de l’autophagie et du stress du réticulum dans les maladies neurodégénératives.
-Mécanismes d’inhibition de l’autophagie au cours de la neurodégénéresence
En plus de la thématique Autophagie, notre équipe s’intéresse à la nécrose régulée au cours du développement et des pathologies (Napoletano et al 2017) ainsi que la dérégulation des métabolisme des lipides au cours des pathologies de la rétine et du cerveau (Van Den Brink et al 2018).
Résumé des projets
Les pathologies du cerveau telles que les maladies de Parkinson ou d’Alzheimer sont dues à un excès de mort des neurones. Chez les patients atteints de la maladie de Parkinson, les neurones présentent des marqueurs de stress comme une activation du stress du réticulum endoplasmique (RE) et de l’autophagie. Le RE est un organite de la cellule ou les protéines sont maturées et repliées ce qui permet leur bon fonctionnement. Dans certaines pathologies, les protéines mal conformées s’accumulent dans le RE ce qui provoque un stress du RE. En réponse à ce défaut de la protéostase, la réponse UPR (unfolded protein response) est activée ce qui induit entre autres l’expression de chaperones qui aident aux repliement des protéines. Nous avons montré qu’un preconditionnement du RE (aussi nommée hormesis du RE), induit génétiquement (mutation affectant le repliement de protéines) ou de façon pharmacologique (tunicamycine, un agent inducteur de stress du RE) protégeait les neurones de la mort cellulaire dans la rétine de Drosophile (Mendes et al 2009). Nous avons ensuite étendu ces observations dans des modèles de maladie de Parkinson chez la Drosophile et chez la souris (Fouillet et al 2012). D’autre part, nous avons mis en évidence que le stress du RE active l’autophagie, ce qui est nécessaire à l’effet protecteur du stress du réticulum endoplasmique contre la mort des neurones. L’identification du stress du réticulum endoplasmique et de l’autophagie en tant que mécanismes protecteurs contre la maladie de Parkinson ouvre de nouvelles perspectives thérapeutiques (Hetz & Mollereau 2014, Mollereau et al 2016).
L’autophagie est un mécanisme de survie cellulaire (à l’exception du cas particulier de la mort autophagique) qui prend une très grande importance dans les cellules à longue durée de vie, tels que les neurones (Boland et al 2018, Napoletano et al in review). Ainsi, le maintien de l’autophagie est un événement clef dans la survie neuronale et l’inhibition de l’autophagie est communément observée dans des modèles de neurodégénérescence.
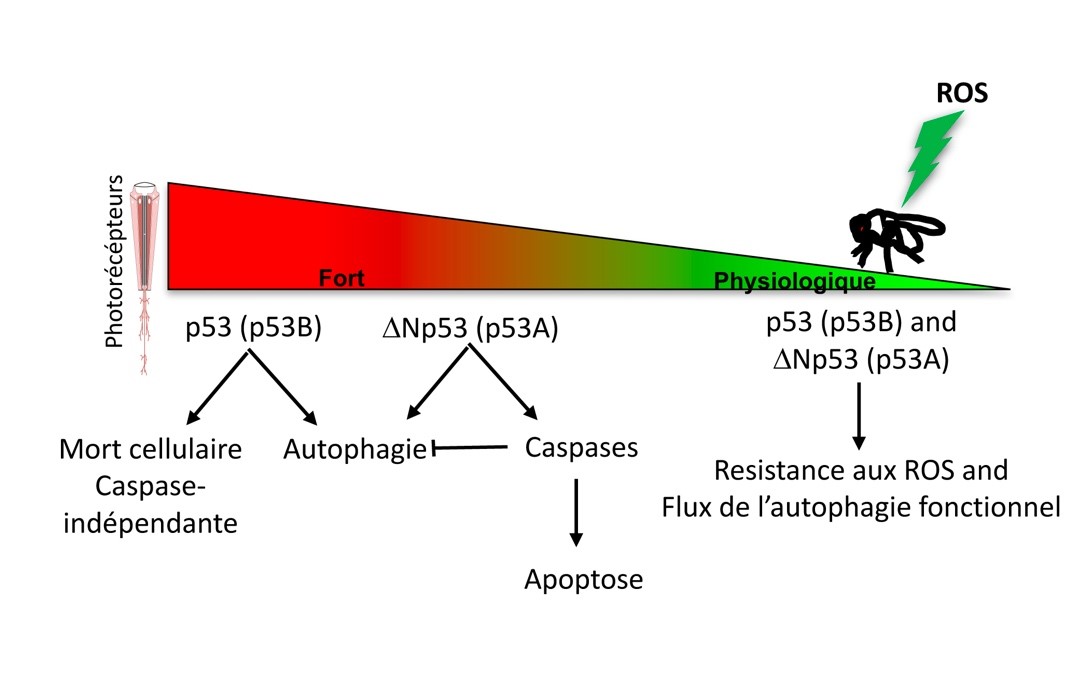
Dans le laboratoire, nous intéressons aux mécanismes inhibiteurs de l’autophagie et nous avons émis l’hypothèse que des acteurs de l’apoptose inhibent le processus autophagique. Dans notre article sous presse dans la revue Autophagy, nous avons montré que l’isoforme de p53, ΔNp53 (p53A) mais pas p53 (p53B), induit une apoptose des photorécepteurs de la rétine de Drosophile. Cette apoptose est associée avec des niveaux élevés de la caspase effectrice Death caspase-1 (Dcp-1) clivée, et une inhibition concomitante de l’autophagie (Robin et al in press) et Figure ci-dessous). De manière intéressante, le flux de l’autophagie peut être restauré par l’inhibition des caspases initiatrice ou effectrices induite par ΔNp53 (p53A). Nos résultats indiquent que les caspases coupent des substrats nécessaires au flux de l’autophagie. La compréhension des mécanismes d’interaction mutuelle entre apoptose et autophagie pourra conduire à une meilleure compréhension des processus neurodégénératifs en vue d’identifier des perspectives thérapeutiques (Napoletano et al in review, Issa et al 2018).
Figure descriptive
Publications
Boland B, Yu WH, Corti O, Mollereau B, Henriques A, Bezard E, Pastores GM, Rubinsztein DC, Nixon RA, Duchen MR, Mallucci GR, Kroemer G, Levine B, et al. 2018. Promoting the clearance of neurotoxic proteins in neurodegenerative disorders of ageing. Nat Rev Drug Discov 17: 660-88
Fouillet A, Levet C, Virgone A, Robin M, Dourlen P, Rieusset J, Belaidi E, Ovize M, Touret M, Nataf S, Mollereau B. 2012. ER stress inhibits neuronal death by promoting autophagy. Autophagy 8: 915-26
Hetz C, Mollereau B. 2014. Disturbance of endoplasmic reticulum proteostasis in neurodegenerative diseases. Nat Rev Neurosci 15: 233-49
Issa AR, Sun J, Petitgas C, Mesquita A, Dulac A, Robin M, Mollereau B, Jenny A, Cherif-Zahar B, Birman S. 2018. The lysosomal membrane protein LAMP2A promotes autophagic flux and prevents SNCA-induced Parkinson disease-like symptoms in the Drosophila brain. Autophagy: 1-13
Mendes CS, Levet C, Chatelain G, Dourlen P, Fouillet A, Dichtel-Danjoy ML, Gambis A, Ryoo HD, Steller H, Mollereau B. 2009. ER stress protects from retinal degeneration. Embo J 28: 1296-307
Mollereau B, Rzechorzek NM, Roussel BD, Sedru M, Van den Brink D, Bailly-Maitre B, Palladino F, Medinas DB, Domingos PM, Hunot S, Chandran S, Birman S, Baron T, et al. 2016. Adaptive preconditioning in neurological diseases – Therapeutic insights from proteostatic perturbations. Brain Res
Napoletano F, Baron O, Vandenabeele P, Mollereau B, Fanto M. in review. Regulated cell death and autophagy. Trends in Cell Biology
Napoletano F, Gibert B, Yacobi-Sharon K, Vincent S, Favrot C, Mehlen P, Girard V, Teil M, Chatelain G, Walter L, Arama E, Mollereau B. 2017. p53-dependent programmed necrosis controls germ cell homeostasis during spermatogenesis. PLoS Genet 13: e1007024
Robin M, Issa AR, Santos CC, Napoletano F, Petitgas C, Chatelain G, Ruby M, Walter L, Birman S, Domingos PM, Calvi BR, Mollereau B. in press. Drosophila p53 integrates the antagonism between autophagy and apoptosis in response to stress. Autophagy
Van Den Brink DM, Cubizolle A, Chatelain G, Davoust N, Girard V, Johansen S, Napoletano F, Dourlen P, Guillou L, Angebault-Prouteau C, Bernoud-Hubac N, Guichardant M, Brabet P, et al. 2018. Physiological and pathological roles of FATP-mediated lipid droplets in Drosophila and mice retina. PLoS Genet 14: e1007627
Composition de l'équipe
Nathalie Davoust, Maitre de Conférence ENS (nathalie.davoust-nataf(at)ens-lyon.fr)
Ludivine Walter, Maitre de Conférence Lyon 1 (ludivine.walter(at)ens-lyon.fr)
Florence Jollivet, Ingénieur d’étude CNRS (florence.jollivet(at)ens-lyon.fr)
Marianne Sedru, doctorante (Marianne.sedru(at)ens-lyon.fr)
Haixiu Jin, doctorante (Haixiu.jin(at)ens-lyon.fr)
Victor Girard, doctorant (Victor.girard(at)ens-lyon.fr)