Mécanismes biologiques des Altérations du Tissu Osseux – MATOs –
UMR E4320 UCA CEA28 Av de Valombrose
06107 Nice cédex 2
FRANCE - Nice
Site web - pierrefi@unice.fr - 0489153523
Responsable d'équipe
Valérie PIERREFITE-CARLE / Georges CARLE

Thématiques de recherche
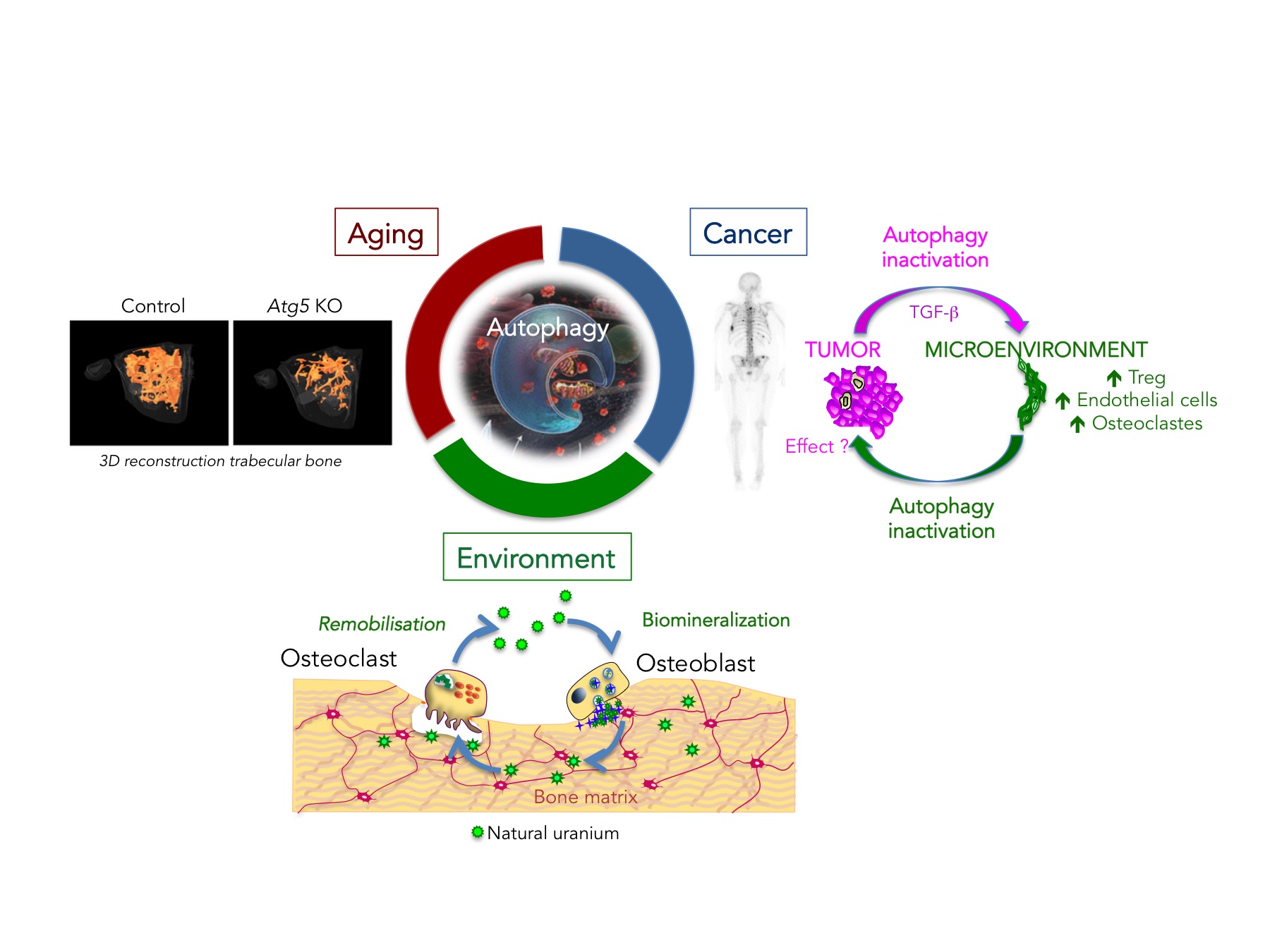
Notre équipe travaille sur la physiopathologie du tissu osseux avec 3 axes sur le cancer, l’environnement, et le vieillissement en étudiant l’implication de l’autophagie comme sujet transversal. L’os est un organe unique dans lequel plusieurs types cellulaires abrités dans une matrice minéralisée agissent de manière coordonnée. Le tissu osseux est constamment renouvelé par l’action de plusieurs types cellulaires : les ostéoblastes (OB) responsables de la production et de la minéralisation de la matrice osseuse, les ostéoclastes (OC) impliqués dans la résorption de cette matrice, et les ostéocytes (OST) qui représentent 90% des cellules de la matrice osseuse et sont considérés comme les chefs d’orchestre de ce processus de remodelage. En condition physiologique normale, nous avons montré que l’autophagie joue un rôle essentiel dans l’ostéoblaste en participant directement à la minéralisation et indirectement à l’équilibre de la balance formation-résorption (Nollet et coll. Autophagy, 2014).
Dans l’axe cancer, nous nous sommes intéressés à l’ostéosarcome, une tumeur primitive osseuse touchant les enfants et les adolescents. Nous avons tout d’abord montré que l’autophagie est le « talon d’Achille » des cellules souches cancéreuses (CSC) d’ostéosarcome. L’autophagie peut en effet être ciblée dans ces cellules par un anti-psychotique, la Thioridazine, qui bloque ce processus et entraîne la mort des CSC de façon très efficace (Camuzard et coll. Cancers, 2020). Nous avons ensuite analysé l’effet de l’inactivation de l’autophagie sur le développement tumoral de l’ostéosarcome. Ce travail nous a permis de démontrer qu’inhiber l’autophagie dans les cellules d’ostéosarcome diminue leurs propriétés tumorigéniques in vitro mais n’affecte pas leur développement in vivo grâce à la création d’un microenvironnement favorable à la tumeur (Camuzard et coll. Autophagy Rep, 2022). Nos résultats montrent qu’une inactivation de l’autophagie dans la tumeur induit une modification du microenvironnement osseux. Inversement, le projet en cours vise à analyser l’effet d’une inactivation de l’autophagie dans le microenvironnement osseux sur le développement de tumeurs osseuses primitives (ostéosarcomes) ou secondaires (métastases osseuses de cancer du sein et de la prostate) (PLBio 2024-2028).
Dans l’axe environnement, nous nous focalisons sur l’effet de l’uranium naturel sur le tissu osseux. Alors que l’utilisation de l’énergie nucléaire est actuellement encouragée en raison du réchauffement climatique et que les attentes de la société en matière de sécurité environnementale augmentent, il est donc essentiel de caractériser les effets de ce métal lourd sur le tissu osseux qui représente son principal site de stockage à long terme. Notre travail a permis de mettre en évidence que l’uranium naturel est biominéralisé dans les ostéoblastes sous forme de cristaux de méta-autunite (phosphate d’uranyle) qui sont ensuite pris en charge par des vésicules autophagiques et relargués dans le milieu extérieur. Nous avons également montré qu’à moyen terme, la présence d’uranium bloque le processus autophagique, ce qui participe à la toxicité de ce métal (Pierrefite-Carle et coll. Arch Toxicol, 2017; Hurault et coll. Toxicol Sci, 2019). Nous analysons actuellement le comportement de faibles doses d’uranium à l’échelle subcellulaire afin d’identifier les mécanismes impactés dont l’autophagie (ANR 2023-2027).
Concernant l’axe vieillissement, nous avons montré que l’autophagie diminue avec l’âge dans le tissu osseux chez la souris. Nous avons également mis en évidence que l’inactivation de l’autophagie aggrave la perte osseuse associée au vieillissement et à la chute des œstrogènes (Camuzard et coll. Oncotarget, 2016). Nous nous intéressons actuellement à l’ostéoporose post-ménopausique qui touche une femme sur 3 et un homme sur 6 après 50 ans. En collaboration avec le service de Rhumatologie du CHU de Nice, nous avons réalisé un essai clinique visant à analyser le niveau d’autophagie osseuse chez des patientes ostéoporotiques (Trojani et coll., manuscrit soumis).
Figure descriptive
Publications
Camuzard O, Nollet M, Santucci-Darmanin S, Trojani, MC, Ben Abderrahman N, Virolle V, Burel-Vandenbos F, Pagnotta S, Orange F, Kolano-Merlin E, Carle GF, Pierrefite-Carle V. Autophagy inactivation in osteosarcoma leads to the appearance of poor prognosis-associated factors. Autophagy Reports. 2022; 1(1):418-437.
Trojani MC, Santucci-Darmanin S, Breuil V, Carle GF, Pierrefite-Carle V. Autophagy and bone diseases. Joint Bone Spine. 2022 May;89(3):105301.
Klionsky DJ, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (4th edition). Autophagy. 2021 Jan;17(1):1-382.
Camuzard O, Trojani MC, Santucci-Darmanin S, Pagnotta S, Breuil V, Carle GF, Pierrefite-Carle V. Autophagy in Osteosarcoma Cancer Stem Cells Is a Critical Process which Can Be Targeted by the Antipsychotic Drug Thioridazine. Cancers (Basel). 2020 Dec 7;12(12):3675.
Camuzard O, Santucci-Darmanin S, Carle GF, Pierrefite-Carle V. Autophagy in the crosstalk between tumor and microenvironment. Cancer Lett. 2020 Oct 10;490:143-153.
Camuzard O, Santucci-Darmanin S, Carle GF, Pierrefite-Carle V. Role of autophagy in osteosarcoma. J Bone Oncol. 2019 Apr 3;16:100235.
Hurault L, Creff G, Hagège A, Santucci-Darmanin S, Pagnotta S, Farlay D, Den Auwer C, Pierrefite-Carle V, Carle GF. Uranium Effect on Osteocytic Cells In Vitro. Toxicol Sci. 2019 Jul 1;170(1):199-209.
Pierrefite-Carle V, Santucci-Darmanin S, Breuil V, Gritsaenko T, Vidaud C, Creff G, Solari PL, Pagnotta S, Al-Sahlanee R, Auwer CD, Carle GF. Effect of natural uranium on the UMR-106 osteoblastic cell line: impairment of the autophagic process as an underlying mechanism of uranium toxicity. Arch Toxicol. 2017 Apr;91(4):1903-1914.
Camuzard O, Santucci-Darmanin S, Breuil V, Cros C, Gritsaenko T, Pagnotta S, Cailleteau L, Battaglia S, Panaïa-Ferrari P, Heymann D, Carle GF, Pierrefite-Carle V. Sex-specific autophagy modulation in osteoblastic lineage: a critical function to counteract bone loss in female. Oncotarget. 2016 Oct 11;7(41):66416-66428.
Pierrefite-Carle V, Santucci-Darmanin S, Breuil V, Camuzard O, Carle GF. Autophagy in bone: Self-eating to stay in balance. Ageing Res Rev. 2015 Nov;24(Pt B):206-17.
Nollet M, Santucci-Darmanin S, Breuil V, Al-Sahlanee R, Cros C, Topi M, Momier D, Samson M, Pagnotta S, Cailleteau L, Battaglia S, Farlay D, Dacquin R, Barois N, Jurdic P, Boivin G, Heymann D, Lafont F, Lu SS, Dempster DW, Carle GF, Pierrefite-Carle V. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 2014;10(11):1965-77.
Composition de l'équipe
Valérie PIERREFITE-CARLE, CR1 INSERM, co-responsable équipe
Georges CARLE, DR1 CNRS, co-responsable équipe
Sabine SANTUCCI-DARMANIN, CR1 CNRS
Véronique BREUIL, PU-PH Rhumatologie
Olivier CAMUZARD, PU-PH Chirurgie réparatrice
Marie-Charlotte TROJANI, Doctorante, Chef de Clinique Rhumatologie
Marie NOLLET, Post-doctorante
Tatiana GRITSAENKO, IR ANR
Chantal CROS, TR UCA
Sarah BOVIS, AJT UCA