Herpesvirus et Autophagie
I2BC Institut de Biologie Intégrative de la CelluleDépartement de Virologie
Gif sur Yvette.
- Gif sur Yvette
Site web - -
Responsable d'équipe
Pr Audrey Esclatine

Thématiques de recherche
Notre équipe, historiquement implantée dans la Faculté de Pharmacie de l’Université Paris-Sud, s’intéresse depuis de nombreuses années aux virus de la famille des Herpès capables d’infecter l’homme. Au cours de ces dernières années, nous avons travaillé sur le virus Herpès Simplex de type 1 (HSV-1), le cytomégalovirus (HCMV) et le virus Epstein-Barr (EBV). Ces virus sont réputés pour très largement moduler et contrecarrer les mécanismes cellulaires antiviraux, notamment en raison d’un génome de taille importante (pour des virus !) et une capacité de codage élevée. Nous avons ainsi étudié les relations qui existent entre infection virale et régulation du processus autophagique dans différents contextes.
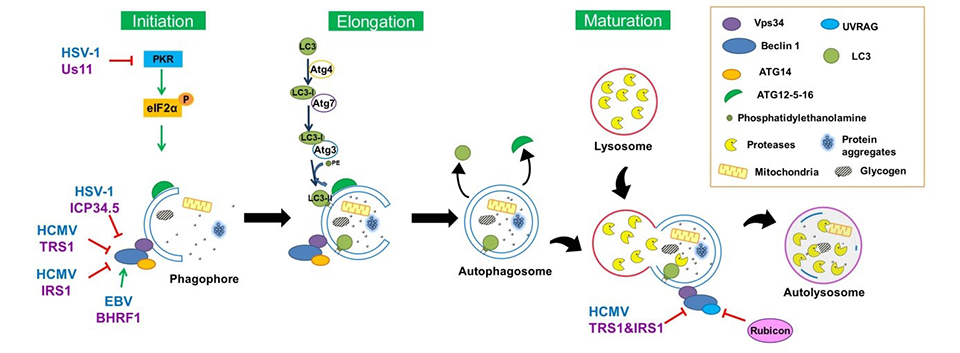
Des protéines virales spécialisées dans la modulation de l’autophagie
Nous avons identifié au laboratoire des protéines de différents Herpesvirus capables de moduler l’autophagie au cours de la multiplication virale et nous avons caractérisé leurs mécanismes d’action. La protéine Us11 est une protéine d’HSV-1 qui est capable de bloquer la formation des autophagosomes aussi bien au cours d’une infection que lorsqu’elle est exprimée seule. Elle agit en inhibant une kinase qui permet de détecter l’ARN double brin d’origine virale (PKR) et dont l’activation entraine l’arrêt de la synthèse des protéines et la stimulation de l’autophagie (5). Us11 vient ainsi compléter l’arsenal de défense d’HSV-1 contre l’autophagie, puisque une première protéine nommée ICP34.5 avait été initialement identifiée par le laboratoire de Beth Levine en 2002. Us11 agit plus tardivement qu’ICP34.5 dans le cycle de multiplication du virus HSV-1. Nous avons montré que le HCMV inhibe lui aussi l’autophagie grâce à au moins deux protéines inhibitrices (3, 6, 7). Les protéines homologues TRS1 et IRS1 bloquent de plusieurs manières le processus autophagique dans sa totalité. Ces protéines sont capables de diminuer la formation des autophagosomes, lorsqu’elles sont exprimées seules en se liant au domaine en superhélice CCD de Beclin1. Lorsqu’elles sont exprimées simultanément, elles bloquent également la dégradation par autophagie, conduisant à une accumulation de la protéine LC3 (3). Plus récemment, nous avons pu montrer en collaboration avec Vincent Maréchal (CIMI, Hôpital Pitié Salpêtrière, Paris) qu’une protéine de l’EBV (BHRF1) en interagissant avec Beclin1 est à l’inverse capable de stimuler la formation des autophagosomes.
Pourquoi les virus modulent l’autophagie ?
De nombreux virus, parmi lesquels plusieurs Herpesvirus, sont capables de moduler l’autophagie pour différentes raisons (1, 2). Il peut s’agir pour le virus de bloquer l’autophagie qui agit alors comme un mécanisme de défense antivirale mis en place par la cellule. Mais cela peut aussi être un moyen pour le virus de détourner tout ou partie du processus autophagique, afin d’optimiser son cycle de multiplication ou de manipuler l’immunité antivirale pour en diminuer l’impact.
Nous avons pu montrer en collaboration avec le laboratoire sicilien de Maria-Teresa Sciortino que l’autophagie pouvait être détournée par HSV-1 à son profit (4). En effet, le virus entraine une activation transitoire de l’autophagie tout au début de l’infection pour améliorer son entrée par endocytose dans les monocytes. Le HCMV, bien que bloquant le processus autophagique, détourne lui aussi une partie de la machinerie autophagique pour améliorer sa production dans les fibroblastes (3). L’invalidation de différents gènes de l’autophagie entraine en effet une diminution globale de la production virale, démontrant un effet proviral de l’autophagie. L’activation de l’autophagie par la protéine virale BHRF1 est aussi mise à profit par l’EBV pour limiter la réponse immunitaire antivirale de la cellule, en jouant notamment sur la morphologie et le devenir des mitochondries.
L’ensemble de ces travaux a été soutenu financièrement par l’ANR et par la Région Ile de France.
Figure descriptive
Publications
1. M. Lussignol et A. Esclatine (2017) Herpesvirus and Autophagy: « All Right, Everybody Be Cool, This Is a Robbery!, Viruses, vol. 9, nᵒ 12, déc. 2017.
2. I. Vergne, F. Lafont, L. Espert, A. Esclatine, et M. Biard-Piechaczyk (2017) Autophagie, protéines ATG et maladies infectieuses, médecine/sciences, vol. 33, nᵒ 3, p. 312-318
3. L. Mouna, E. Hernandez, D. Bonte, R. Brost, L. Amazit, L. R. Delgui, W. Brune, A. P. Geballe, I. Beau, et A. Esclatine (2016), « Analysis of the role of autophagy inhibition by two complementary human cytomegalovirus BECN1/Beclin 1-binding proteins, Autophagy, vol. 12, nᵒ 2, p. 327-342
4. G. Siracusano, A. Venuti, D. Lombardo, A. Mastino, A. Esclatine, et M. T. Sciortino, (2016) Early activation of MyD88-mediated autophagy sustains HSV-1 replication in human monocytic THP-1 cells, Scientific Reports, vol. 6, p. 31302
5. Lussignol M, Queval C, Bernet-Camard MF, Cotte-Laffitte J, Beau I, Codogno P, Esclatine A (2013) The Herpes Simplex Virus 1 Us11 Protein Inhibits Autophagy through Its Interaction with the Protein Kinase PKR. J Virol 87 : 859-871
6. Chaumorcel M, Lussignol M, Mouna L, Cavignac Y, Fahie K, Cotte-Laffitte J, Geballe A, Brune W, Beau I, Codogno P, Esclatine A (2012) The human cytomegalovirus protein TRS1 inhibits autophagy via its interaction with Beclin 1. J Virol 86 : 2571-2584
7. Chaumorcel M, Souquère S, Pierron G, Codogno P, Esclatine A. (2008) Human cytomegalovirus controls a new autophagy-dependent cellular antiviral defense mechanism. Autophagy 4(1):46-53
Composition de l'équipe
Audrey Esclatine, Professeur de Virologie, Univ Paris-Sud
Marion Lussignol, Maître de Conférences, Univ Paris-Sud
Eva Hernandez-Djebali, Ingénieure d’étude, Univ Paris-Sud
Clémence Taisne, Doctorante, Univ Paris-Sud
Damien Glon, Etudiant en Master 2, Univ Paris-Sud