Protéines à activité suppressive de tumeur
Centre de Recherche en Cancérologie de Marseille (CRCM)Inserm U1068 – CNRS UMR7258 – Institut Paoli-Calmettes – Aix-Marseille Université
Equipe Stress Cellulaire (Dir. Juan Iovanna)
Campus de Luminy Case 915, 163 Avenue de Luminy, 13288 Marseille Cedex 9 - Marseille
Site web - alice.carrier@inserm.fr -
Responsable d'équipe
Alice Carrier

Thématiques de recherche
Notre laboratoire se consacre à l’étude de la réponse au stress cellulaire pendant la carcinogenèse pancréatique afin d’améliorer les connaissances sur ce cancer dramatique et de développer de nouvelles stratégies en clinique.
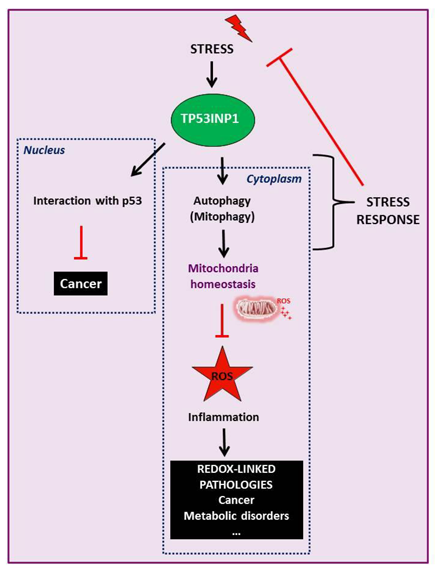
Dans ce contexte, mon groupe a identifié une nouvelle protéine de stress, la Tumor Protein 53-Induced Nuclear Protein 1 (TP53INP1), qui est surexprimée dans toute situation de stress y compris lors d’une inflammation in vivo, de manière dépendante ou indépendante de p53. Nous avons montré que TP53INP1 est perdue dans les stades précoces de la tumorigenèse dans plusieurs tissus humains dont le pancréas. Les souris déficientes pour TP53INP1 développées au laboratoire ont confirmé son activité suppressive de tumeur associée à son rôle dans la régulation du stress oxydatif. Cette action anti-tumorale se joue à la fois dans le noyau (par modulation de l’activité de p53) et dans le cytoplasme où TP53INP1 participe au processus autophagique. Ainsi l’activité de contrôle redox de TP53INP1 est liée à sa participation dans la mitophagie qui élimine les mitochondries endommagées, source majeure d’espèces réactives de l’oxygène (ROS).
Il est à noter que le paralogue de TP53INP1 (TP53INP2 ou DOR) est aussi un acteur de l’autophagie et que ces 2 protéines sont impliquées dans la prévention du syndrome métabolique (obésité et diabète) par leur impact sur le métabolisme cellulaire.
Nos projets actuels visent à:
1- Poursuivre la caractérisation du rôle de TP53INP1 dans la mitophagie, dans le contexte de l’étude de sa fonction lors du vieillissement, dans différents organes : moelle osseuse (collaboration avec l’équipe d’Estelle Duprez, spécialiste de l’hématopoièse, CRCM Marseille) et cerveau (collaboration avec l’équipe de Lydia Kerkerian, spécialiste de la maladie de Parkinson, IBDM Marseille).
2- Décrypter les dysfonctionnements du compartiment mitochondrial dans le cancer pancréatique, à la fois au niveau fonctionnel (respiration, apoptose) et dynamique (biogenèse, fusion/fission, mitophagie), élucider comment les dérégulations mitochondriales soutiennent la croissance tumorale et la résistance thérapeutique, et développer de nouvelles études précliniques en ciblant les mitochondries.
Figure descriptive
Publications
Carrier A. (2016). Metabolic syndrome and oxidative stress: a complex relationship (Forum Editorial). Antioxid Redox Signal, in press.
Amri F, Ghouili I, Amri M, Carrier A*, Masmoudi-Kouki O*. (2016). Neuroglobin protects astroglial cells from hydrogen peroxide-induced oxidative stress and apoptotic cell death. J Neurochem., in press. *co-senior author.
Klionsky et al. (2016). Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy 12, 1-222.
Saadi H, Seillier M, Carrier A. (2015). The stress protein TP53INP1 plays a tumor suppressive role by regulating metabolic homeostasis. Biochimie, Nov;118:44-50. doi: 10.1016/j.biochi.2015.07.024. Epub 2015 Jul 27. Review.
Seillier M, Pouyet L, N’guessan P, Nollet M, Capo F, Guillaumond F, Peyta L, Dumas JF, Varrault A, Bertrand G, Bonnafous S, Tran A, Meur G, Marchetti P, Ravier MA, Dalle S, Gual P, Muller D, Rutter GA, Servais S, Iovanna JL, Carrier A. (2015). Defects in mitophagy promote redox-driven metabolic syndrome in the absence of TP53INP1. EMBO Molecular Medicine 7, 802-818. DOI – 10.15252/emmm.201404318
Brisson L, Carrier A. (2015). A novel actor in anti-tumoral immunity: the Thymus-Specific Serine Protease TSSP/PRSS16 involved in CD4+ T cell maturation. OncoImmunol, Apr 2;4(9):e1026536. eCollection 2015 Sep.
Brisson L, Pouyet L, N’guessan P, Garcia S, Lopes N, Warcollier G, Iovanna JL, Carrier A. (2015). The Thymus-Specific Serine Protease TSSP/PRSS16 is crucial for the anti-tumoral role of CD4+ T cells. Cell Reports 10, 39-46. DOI – 10.1016/j.celrep.2014.12.009
Shahbazi J, Scarlett CJ, Norris MD, Liu B, Haber M, Tee AE, Carrier A, Biankin AV, Marshall GM, Lock RB, Liu T. (2014). Histone deacetylase 2 and N-Myc reduce p53 protein phosphorylation at serine 46 by repressing gene transcription of Tumor Protein 53 induced nuclear protein 1. Oncotarget 5, 4257-4268.
Saadi H, Seillier M, Sandi MJ, Peuget S, Kellenberger C, Gravis G, Dusetti NJ, Iovanna JL, Rocchi P, Amri M, Carrier A. (2013). Development of an ELISA detecting Tumor Protein 53-Induced Nuclear Protein 1 in serum of prostate cancer patients. Results in Immunology 3, 51-56.
Al Saati T, Clerc P, Hanoun N, Peuget S, Lulka H, Gigoux V, Capilla F, Béluchon B, Couvelard A, Selves J, Buscail L, Carrier A, Dusetti N, Dufresne M. (2013). Oxidative Stress Induced by Inactivation of TP53INP1 Cooperates with KrasG12D to Initiate and Promote Pancreatic Carcinogenesis in the Murine Pancreas. Am J Pathol. 182, 1996-2004.
Seillier M, Peuget S, Gayet O, Gauthier C, N’Guessan P, Monte M, Carrier A, Iovanna JL, Dusetti N. (2012). TP53INP1, a tumor suppressor, interacts with LC3 and ATG8-family proteins through the LC3-interacting region (LIR) and promotes autophagy-dependent cell death. Cell Death Differ 19, 1525-1535.
Composition de l'équipe
Alice Carrier, CR1 CNRS
Rawand Masoud, Post-Doc Fondation ARC
Sophie Lac, Ingénieur FRM
Fatma Amri, Doctorante
Bochra Zidi, Doctorante