Microenvironnement tumoral et résistance aux traitements
Campus Val d’Aurelle208 avenue des Apothicaires - Montpellier
Site web - sophie.pattingre@inserm.fr - 0467618577
Responsable d'équipe
Sophie Pattingre

Thématiques de recherche
Notre équipe s’intéresse au rôle du microenvironnement tumoral dans l’agressivité de la tumeur et la réponse aux traitements anti-cancéreux. Les différents acteurs du stroma tumoral sont les fibroblastes associés au cancer, les cellules endothéliales ou immunitaires. La caractérisation des cellules immunitaires (immunoscore) est désormais utilisée pour le pronostic ou la prédiction de la réponse au traitement alors que le ciblage des cellules endothéliales avec des anti-VEGF est couramment utilisé en clinique. Il reste toutefois un élément négligé dans la recherche anti-cancer puisque au sein de la tumeur, se retrouvent des nerfs intiment liés aux cellules cancéreuses. L’interaction entre les cellules tumorales et les neurones signe, en effet, l’agressivité de la tumeur et la résistance aux chimiothérapies ou à la radiothérapie. Leur présence au sein de la tumeur est un élément diagnostic utilisé en routine lors des examens anatomo-pathologiques. Grâce à une étroite collaboration avec le service de Pathologie de l’Institut du Cancer de Montpellier (ICM), nous étudions le rôle de l’autophagie dans l’interaction entre cellules cancéreuses et les neurones afin de comprendre la mécanistique de cette interaction et son rôle dans la réponse à la radiothérapie dans le cancer colorectal.
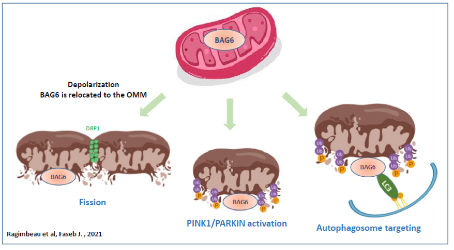
Parallèlement à ces études translationnelles, nous étudions la mécanistique de régulation de la mitophagie dans les cellules cancéreuses. Nous avons ainsi montré que le co-chaperonne BAG6 était indispensable à la mitophagie et montré que (1) BAG6 induit la fission mitochondriale, un prérequis à la mitophagie, (2) BAG6 stimule la voie PINK1/PARKIN et enfin (3) que BAG6, via un domaine LIR, interagit avec LC3 est que cette interaction est indispensable à la mitophagie, suggérant que BAG6 est un nouveau récepteur pour l’autophagie sélective (Ragimbeau et, 2021).
Figure descriptive
Publications
BAG6 promotes PINK1 signaling pathway and is essential for mitophagy. Ragimbeau R, El Kebriti L, Sebti S, Fourgous E, Boulahtouf A, Arena G, Espert L, Turtoi A, Gongora C, Houédé N, Pattingre S. FASEB J. 2021.
Metastatic colorectal cancer cells maintain the TGFβ program and use TGFBI to fuel angiogenesis. Chiavarina B, Costanza B, Ronca R, Blomme A, Rezzola S, Chiodelli P, Giguelay A, Belthier G, Doumont G, Van Simaeys G, Lacroix S, Yokobori T, Erkhem-Ochir B, Balaguer P, Cavailles V, Fabbrizio E, Di Valentin E, Gofflot S, Detry O, Jerusalem G, Goldman S, Delvenne P, Bellahcène A, Pannequin J, Castronovo V, Turtoi A. Theranostics. 2021. 11:1626-1640.
Paracrine interactions of cancer-associated fibroblasts, macrophages and endothelial cells: tumor allies and foes. Ronca R, Van Ginderachter JA, Turtoi A. Curr Opin Oncol. 2018. 30:45-53.
Murine stroma adopts a human-like metabolic phenotype in the PDX model of colorectal cancer and liver metastases. Blomme A, Van Simaeys G, Doumont G, Costanza B, Bellier J, Otaka Y, Sherer F, Lovinfosse P, Boutry S, Palacios AP, De Pauw E, Hirano T, Yokobori T, Hustinx R, Bellahcène A, Delvenne P, Detry O, Goldman S, Nishiyama M, Castronovo V, Turtoi A.Oncogene. 2018. 37:1237-1250.
BAG6/BAT3 modulates autophagy by affecting EP300/p300 intracellular localization. Sebti S, Prébois C, Pérez-Gracia E, Bauvy C, Desmots F, Pirot N, Gongora C, Bach AS, Hubberstey AV, Palissot V, Berchem G, Codogno P, Linares LK, Liaudet-Coopman E, Pattingre S. Autophagy. 2014. 1341-2.
BAT3 modulates p300-dependent acetylation of p53 and autophagy-related protein 7 (ATG7) during autophagy. Sebti S, Prébois C, Pérez-Gracia E, Bauvy C, Desmots F, Pirot N, Gongora C, Bach AS, Hubberstey AV, Palissot V, Berchem G, Codogno P, Linares LK, Liaudet-Coopman E, Pattingre S. Proc Natl Acad Sci U S A. 2014. 111:4115-20.
Composition de l'équipe
Sophie Pattingre (CRCN, INSERM, Responsable du projet Autophagie)
Ikrame Dadi (PhD student)
Marie-Alix Poul (PU, Université de Montpellier 2)
Didier Pourquier (Pathologiste, ICM, Montpellier)
Régis Souche (PHU, CHU Montpellier)
Andrei Turtoi (CRCN, INSERM, Chef d’équipe)