Dynamique intracellulaire des structures sous virales
Microbiologie Fondamentale et Pathogenicité,MFP CNRS UMR 5234, Univ. Bordeaux
146 rue Leo Saignat, Bat2B, 1ere etage
33076 Bordeaux cedex, France - Bordeaux
Site web - harald.wodrich@u-bordeaux.fr - 0557571130
Responsable d'équipe
Harald Wodrich (Groupe Adenovirus)

Thématiques de recherche
L’équipe « Dynamique intracellulaire des structures sous virales » de l’Université de Bordeaux est co-dirigée par Michael Kann (PR1, Université de Bordeaux) et Harald Wodrich (DR2, INSERM). Elle est composée de deux sous-groupes, chacun étudiant des modèles viraux différents. Notre intérêt commun est de mieux comprendre les étapes précoces de l’infection virale (transport à travers le cytoplasme et import nucléaire) et les interactions avec les facteurs de restriction de l’hôte.
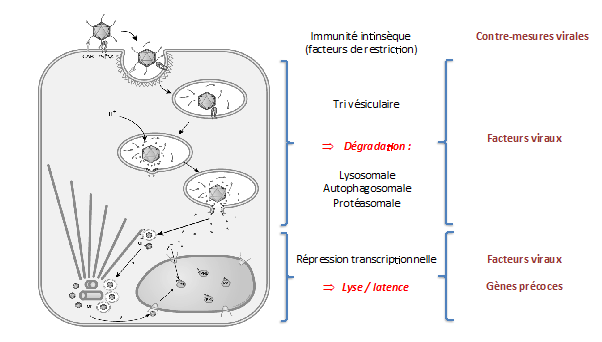
Notre groupe étudie plus particulièrememnt les adénovirus (Adv), des virus à ADN non-enveloppés qui se répliquent dans le noyau de cellules non-proliférantes et qui constituent un des systèmes les plus efficaces de délivrance nucléaire de génomes viraux. Les Adv entrent dans les cellules par endocytose clathrine dépendante à la suite de leur interaction avec le récpteur CAR et les intégrines. Ils induisent ensuite la lyse de l’endosome et les particules virales sont transportées jusqu’aux pores nucléaires, où elles subiront un désassemblage de leur capside permettant la libération et l’import nucléaire du génome viral. Nous avons développé des approches d’imagerie in vivo afin de mieux comprendre l’organisation spatio-temporelle de ces relations hôte/pathogène dans des cellules vivantes. Nous nous concentrons sur 2 étapes clefs des processus d’entrée. Une partie de l’équipe essaye de comprendre comment l’Adv interagit au niveau du complexe de pore nucléaire (NPC), relargue sont génome dans le noyau et comment ces évenements sont détectés par la cellule hôte (Ref. 1 à 5).
Un autre aspect de nos recherches plus intéressant pour la communauté de l’autophagie consiste à essayer de mieux appréhender les mécanismes de rupture et d’échappement de l’endosome mis en œuvre par le virus pour pénétrer le cytosol et comment la cellule réagit à ces dommages. Des travaux antérieurs ont montré qu’un désassemblage partiel de la capside virale dans l’endosome induit le relarguage de la protéine VI de la capside. Cette protéine contient une hélice amphipatique localisée dans sa partie N-terminale capable de déstabiliser et d’induire la rupture de la membrane endosomale, permettant l’échappement endosomal du virus (Ref. 6-7). Nous avons pu montré par des techniques de vidéomicroscopie que rupture de l’endosome et échappement endosomal sont 2 évènements séparés (Ref. 8-9) et que ce dernier processus fait intervenir un motif PPxY présent sur la proteine VI en plus de son hélice amphipatique (Ref. 10). Plus récemment, nous avons montré que, comme c’est le cas avec des bactéries invasives comme les salmonelles, les dommages membranaires induits par l’Adv activent l’autophagie sélective et que c’est spécifiquement la Galectine 8 qui cible ces dommages vers la machinerie autophagique (Ref. 11). En utilisant un virus muté dans le motif PPxY de la protéine VI, nous avons également montré que le virus utilise ce motif pour recruter des ubiquitine ligases de la famille de Nedd4 (Nedd4.2 plus spécifiquement) afin de bloquer la dégradation autophagosomale en inhibant la maturation des autophagosomes. Un défaut de maturation des autophagosomes a également été observé dans des cellules non infectées dans lesquelles l’expression de Nedd4.2 a été abolie, suggérant que le virus pourrait détourner Nedd4.2 de sa fonction physiologique dans la régulation de l’autophagie. De plus, nous avons pu mettre en évidence que non seulement les Adv peuvent bloquer leur dégradation par les processus autophgiques, mais qu’ils sont aussi capables de détourner une partie de cette machinerie (notamment LC3) pour accélerer leur transport rétrograde vers le noyau (Ref. 11).
Sur la base de ces travaux, nous nous efforcons désormais de caractériser les bases moléculaires i) du rôle de Nedd4.2 dans la régulation des processus autophagiques et de son détournement par le virus via le motif PPxY de sa protéine VI et ii) de comment l’Adv utilise la machinerie de l’autophagie pour accélérer son transport vers le noyau grâce à LC3.
Figure descriptive
Publications
1-Komatsu T, Nagata K, Wodrich H. The Role of Nuclear Antiviral Factors against Invading DNA Viruses: The Immediate Fate of Incoming Viral Genomes. Viruses. 2016 Oct 22;8(10). Review.
2-Komatsu T, Nagata K, Wodrich H. An adenovirus DNA replication factor, but not incoming genome complexes, targets PML nuclear bodies. J Virol. 2015 Nov 25. pii: JVI.02545-15
3-Cassany A, Ragues J, Guan T, Bégu D, Wodrich H, Kann M, Nemerow G and Gerace L. Docking of adenovirus to the nuclear pore complex requires direct interaction with an N-terminal domain of the nucleoporin Nup214. J Virol. 2015 Feb;89(3):1719-30.
4- Schreiner S, Martinez R, Groitl P, Rayne F, Vaillant R, Wimmer P, Bossis G, Sternsdorf T, Marcinowski L, Ruzsics Z, Dobner T, Wodrich H. Transcriptional activation of the adenoviral genome is mediated by capsid protein VI. PLoS Pathog. 2012 Feb;8(2):
5-Wodrich* H*., Cassany A., D’Angelo MA, Guan T., Nemerow G. and Gerace L Adenoviral core protein pVII is translocated into the nucleus by multiple import receptor pathways J. Virol 2006 Oct ; 80(19) :9608-18
6-Wiethoff CM, Wodrich H, Gerace L, Nemerow GR. Adenovirus protein VI mediates membrane disruption following capsid disassembly. J Virol. 2005 Feb;79(4)
7-Martinez R, Schellenberger P, Vasishtan D, Aknin C, Austin S, Dacheux D, Rayne F, Siebert A, Ruzsics Z, Gruenewald K, Wodrich H. The amphipathic helix of adenovirus capsid protein VI contributes to penton release and postentry sorting. J Virol. 2015 Feb;89(4):2121-35.
8-Maier O, Marvin SA, Wodrich H, Campbell EM, Wiethoff CM. Spatiotemporal dynamics of adenovirus membrane rupture and endosomal escape. J Virol. 2012 Oct;86(19):10821-8
9-Martinez R, Burrage AM, Wiethoff CM Wodrich H. High temporal resolution imaging reveals endosomal membrane penetration and escape of adenoviruses in real-time. Methods Mol Biol. 2013;1064:211-26
10-Wodrich H, Henaff D, Jammart B, Segura-Morales C, Seelmeir S, Coux O, Ruzsics Z, Wiethoff CM, Kremer EJ. A capsid-encoded PPxY-motif facilitates adenovirus entry. PLoS Pathog. 2010 Mar 19;6(3)
11-Montespan C, Marvin SA, Austin S, Burrage AM, Roger B, Rayne F, Faure M, Campell EM, Schneider C, Reimer R, Grünewald K, Wiethoff CM, Wodrich H. Multi-layered control of Galectin-8 mediated autophagy during adenovirus cell entry through a conserved PPxY motif in the viral capsid. PLoS Pathog. 2017 Feb 13;13(2)
Composition de l'équipe
Harald Wodrich (GER) (INSERM DR2)
Marie-Edith Lafon (FR) (PU-PH, CHU Bordeaux)
Fabienne Rayne (FR) (MCU Univ. de Bordeaux)
Benoit Roger (FR) (MCU Univ. de Bordeaux)
Irene Carlon (ESP) (Ph. D student, 2014-17)
Noemi Pied (FR) (Ph. D student, 2015-18)
Floriane Lagadec (FR) (Ph. D student, 2016-19)
Aurelien Chuard (FR) (Master 2 student)
Emma Soussens (FR) (Master 1 student)
Membres techniques/administratifs partagés:
Muriel Faure (FR) (Technicienne)
Jessica Ragues (FR) (Technicienne)
Valerie Doussett (FR) (Gestion administrative)