Physiopathologie endothéliale et vésicules extracellulaires
Hôpital Européen Georges Pompidou56 rue Leblanc - Paris
Site web - chantal.boulanger@inserm.fr - 33153988086
Responsable d'équipe
Chantal M. Boulanger

Thématiques de recherche
Nos travaux se concentrent sur le rôle de l’autophagie dans les cellules endothéliales, et plus particulièrement, dans la physiopathologie des maladies liées au syndrome métabolique (obésité, insulinorésistance ou diabète de type 2, dyslipidémie et hypertension).
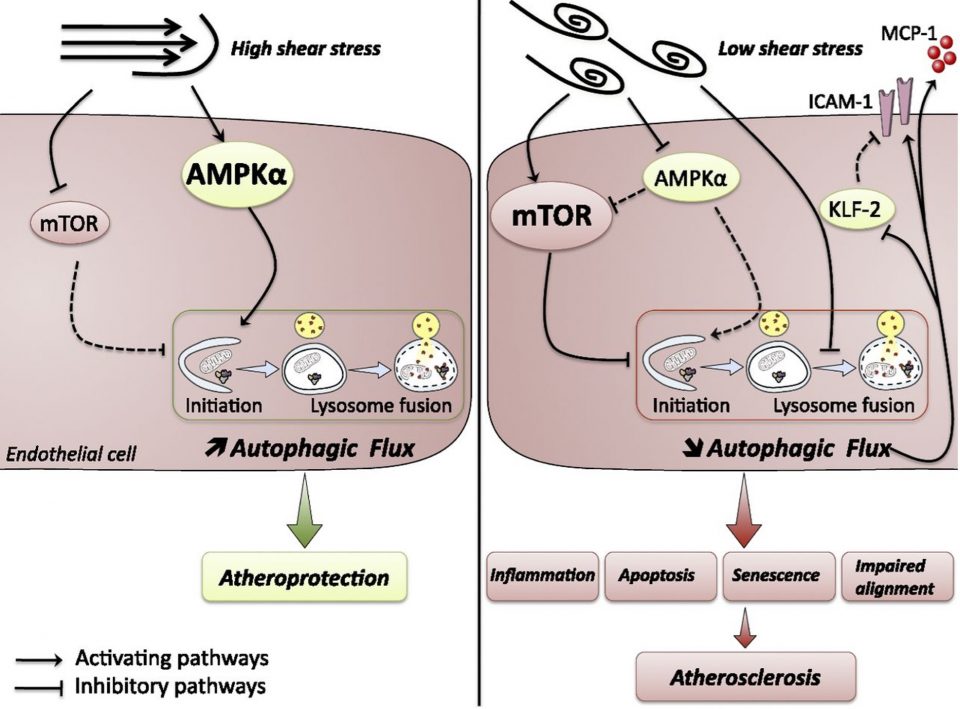
L’athérosclérose est la conséquence artérielle du syndrome métabolique. Il s’agit d’une maladie inflammatoire des grandes artères se développant préférentiellement dans des zones spécifiques de l’arbre vasculaire, telles que les bifurcations et les courbures artérielles, où le flux sanguin est perturbé et exerce de faibles contraintes de cisaillement sur l’endothélium. A l’inverse, les régions exposées à de fortes contraintes de cisaillement sont généralement protégées du développement de plaques. Nous avons démontré que l’autophagie est activée dans les zones de fortes contraintes de cisaillement et protège contre la formation de plaques d’athérosclérose (Fig.1 ; Vion, Kheloufi et al., PNAS 2017). En revanche, le flux autophagique est bloqué dans les zones de faibles contraintes de cisaillement. Ce défaut est responsable de la formation préférentielle de la plaque dans les zones de faible cisaillement, via la mise en place un phénotype endothélial inflammatoire, apoptotique et sénescent. Actuellement, nous évaluons si une stimulation du processus autophagique, dans des cellules endothéliales soumises à des conditions athérogènes, pourrait inhiber les processus d’inflammation et la formation de lésions d’athérosclérose. Le réseau de microtubules étant un acteur essentiel au cours de la formation des autophagosomes et de leur fusion avec les lysosomes, nous testons une stratégie de stabilisation des microtubules, via l’acétylation de l’α-tubuline, pour restaurer un flux autophagique adéquat.
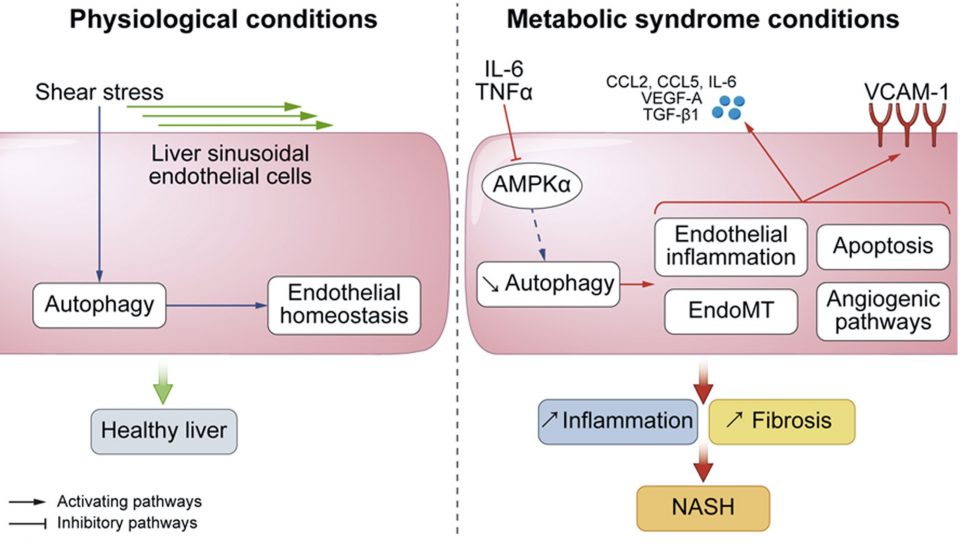
La stéatose hépatique non alcoolique est la manifestation hépatique du syndrome métabolique. Elle englobe un spectre de lésions histologiques allant de la simple stéatose à la stéatohépatite non alcoolique (NASH) qui comprend, en plus de la stéatose, des lésions hépatocellulaires, une inflammation et un degré variable de fibrose, et peut évoluer vers la cirrhose et le cancer du foie. Nous avons récemment démontré que l’autophagie est défectueuse dans les cellules endothéliales hépatiques de patients atteints de NASH et que ce défaut est induit par des médiateurs inflammatoires présents dans le sang porte des patients atteints du syndrome métabolique (Fig. 2). Nous avons également démontré qu’une réduction du flux autophagique induit une altération des cellules endothéliales hépatiques, responsable de l’inflammation du foie, de la mort cellulaire et de la fibrose, favorisant alors le développement de la NASH (Hammoutene et al., J. Hepatol 2019). Nos travaux démontrent que l’autophagie est un processus clé impliqué dans l’homéostasie des cellules endothéliales dans un contexte de syndrome métabolique dans différents lits vasculaires. Cibler l’autophagie endothéliale est donc une stratégie intéressante pour la prise en charge des troubles liés au syndrome métabolique.
Par ailleurs, notre équipe a été pionnière dans la recherche sur la libération de vésicules extracellulaires (corps apoptotiques, microvésicules ou exosomes) par des cellules endothéliales dysfonctionnelles. Il s’agit de particules à bicouches lipidiques renfermant du matériel cytosolique provenant de différents compartiments subcellulaires. Nous testons l’hypothèse selon laquelle une modification des niveaux de vésicules extracellulaires circulantes représenterait une signature du dysfonctionnement vasculaire. Nous avons précédemment observé une libération accrue de microvésicules endothéliales dans des conditions de faibles contraintes de cisaillement (Vion et al, Circ Res 2013). Nous explorons actuellement le rôle du processus autophagique dans la biogénèse de ces vésicules. Le défaut de flux autophagique, observé dans les conditions athérogènes, pourrait modifier le contenu et la fonction des vésicules extracellulaires endothéliales. Les premières données indiquent que l’inhibition de l’autophagie endothéliale conduit à un enrichissement en protéines d’adhésion et en composants mitochondriaux, ce qui pourrait alors avoir un impact sur le devenir de ces vésicules, ainsi que sur les cellules qui les incorporent. Les vésicules extracellulaires circulantes pourraient donc contenir des informations biologiques essentielles pour la découverte de nouveaux biomarqueurs du dysfonctionnement endothélial.
Figure descriptive
Publications
Anne-Clémence Vion, Bhama Ramkhelawon, Xavier Loyer, Gilles Chironi, Cecile Devue, Gervaise Loirand, Alain Tedgui, Stéphanie Lehoux, Chantal M Boulanger. Shear stress regulates endothelial microparticle release. Circ Res 2013, 112(10):1323-1333.
Anne-Clemence Vion*, Marouane Kheloufi*, Adel Hammoutene, Johanne Poisson, Juliette Lasselin, Cecile Devue, Isabelle Pic, Nicolas Dupont, Johanna Busse, Konstantin Stark, Julie Lafaurie-Janvore, Abdul I Barakat, Xavier Loyer, Michele Souyri, Benoit Viollet, Pierre Julia, Alain Tedgui, Patrice Codogno, Chantal M Boulanger# and Pierre-Emmanuel Rautou#. Autophagy is required for endothelial cell alignment and atheroprotection under physiological blood flow. Proc Natl Acad Sci USA 2017, 114(41):E8675-E8684. (* and #: equally contributed to the work)
Marouane Kheloufi, Anne-Clemence Vion, Adel Hammoutene, Johanne Poisson, Juliette Lasselin, Cecile Devue, Isabelle Pic, Nicolas Dupont, Johanna Busse, Konstantin Stark, Julie Lafaurie-Janvore, Abdul I. Barakat, Xavier Loyer, Michele Souyri, Benoit Viollet, Pierre Julia, Alain Tedgui, Patrice Codogno, Chantal M. Boulanger and Pierre-Emmanuel Rautou. Endothelial autophagic flux hampers atherosclerotic lesion development. Autophagy 2018, 14(1):173–175.
Adel Hammoutene, Louise Biquard, Juliette Lasselin, Marouane Kheloufi, Marion Tanguy, Anne-Clémence Vion, Jules Mérian, Nathalie Colnot, Xavier Loyer, Alain Tedgui, Patrice Codogno, Sophie Lotersztajn, Valérie Paradis, Chantal M Boulanger and Pierre-Emmanuel Rautou. A defect in endothelial autophagy occurs in patients with non-alcoholic steatohepatitis and promotes inflammation and fibrosis. J Hepatol 2020, 72(3):528-538
Composition de l'équipe
Chantal M. Boulanger, DR InsermXavier Loyer, CR Inserm
Olivier Blanc-Brude, CR CNRS
Dominique Charue, IE Inserm
Cecile Devue, AI Inserm
Fariza Mezine, IE
Michaël Robillard, IE
Pierre-Michaël Coly, Post-doctorant
Shruti Chatterjee, Post-doctorante
Stephane Mazlan, Post-doctorant
Pierre Julia, Clinicien
Sylvain Lejeune, Clinicien
Nicolas Amabile, Clinicien